题目内容
在Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O反应中,请用“双线桥法”标出元素化合价升降、电子得失和被氧化、被还原的情况.______,氧化剂______;还原剂______.
Cu(NO3)2+2NO2↑+2H2O反应中,请用“双线桥法”标出元素化合价升降、电子得失和被氧化、被还原的情况.______,氧化剂______;还原剂______.
【答案】分析:氧化还原反应中氧化还原反应中的,化合价升高值=化合价降低值=转移电子数目;化合价升高的元素的原子失去电子被氧化,化合价降低的元素的原子得到电子被还原,化合价降低的元素所在的反应物是氧化剂,化合价升高的元素所在的反应物是还原剂.
解答:解:反应方程式Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,中化合价变化为:Cu→Cu(NO3)2,Cu元素由0价→+2价,一个Cu原子失2个电子,所以Cu是还原剂;HNO3→NO2,N元素由+5价→+4价,一个HNO3分子得一个电子,所以HNO3是氧化剂;其得失电子数为2,所以其转移电子数为2,即 ,
,
故答案为: ;HNO3;Cu.
;HNO3;Cu.
点评:本题考查学生氧化还原反应的有关知识,是对教材知识的考查,难度不大.
解答:解:反应方程式Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,中化合价变化为:Cu→Cu(NO3)2,Cu元素由0价→+2价,一个Cu原子失2个电子,所以Cu是还原剂;HNO3→NO2,N元素由+5价→+4价,一个HNO3分子得一个电子,所以HNO3是氧化剂;其得失电子数为2,所以其转移电子数为2,即
 ,
,故答案为:
 ;HNO3;Cu.
;HNO3;Cu.点评:本题考查学生氧化还原反应的有关知识,是对教材知识的考查,难度不大.

练习册系列答案
相关题目
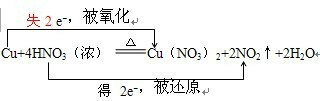

 Cu(NO3)2+2NO2↑+2H2O反应中,请用“双线桥法”标出元素化合价升降、电子得失和被氧化、被还原的情况.________,氧化剂________;还原剂________.
Cu(NO3)2+2NO2↑+2H2O反应中,请用“双线桥法”标出元素化合价升降、电子得失和被氧化、被还原的情况.________,氧化剂________;还原剂________.