题目内容
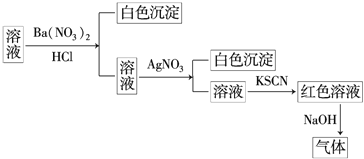
【题目】某同学为检验某溶液中是否含有常见的四种无机离子,进行了如图所示的实验操作.其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝.由该实验能得到的正确结论是![]()
A.原溶液中一定含有![]() B.原溶液中一定含有
B.原溶液中一定含有![]()
C.原溶液中一定含有![]() D.原溶液中一定含有
D.原溶液中一定含有![]()
【答案】B
【解析】
![]() 原溶液中加入盐酸酸化的硝酸钡,如果其中含有亚硫酸根离子,则会被氧化为硫酸根离子,所以原溶液中不一定含有
原溶液中加入盐酸酸化的硝酸钡,如果其中含有亚硫酸根离子,则会被氧化为硫酸根离子,所以原溶液中不一定含有![]() 离子,选项A错误;
离子,选项A错误;
B.产生能使红色石蕊试纸变蓝的气体是氨气,所以原来溶液中一定含有![]() ,选项B正确;
,选项B正确;
C.原溶液中加入盐酸酸化的硝酸钡,引进了氯离子,能和硝酸银反应生成氯化银沉淀的离子不一定是原溶液中含有的氯离子,可能是加进去的盐酸中的氯离子,选项C错误;
D.原溶液中加入盐酸酸化的硝酸钡,如果其中含有亚铁离子,则亚铁离子会被氧化为铁离子,铁离子能使硫氰酸钾变为红色,所以原溶液中不一定含有![]() 离子,选项D错误;
离子,选项D错误;
答案选B。

练习册系列答案
相关题目
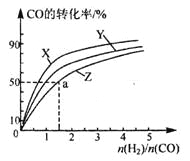
【题目】一定条件下存在反应C(s)+H2O(g)![]() CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | V |
温度 | T1℃ | T2℃ | T1℃ |
起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |

A. 甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B. 丙容器的体积V>0.5L
C. 当温度为T1℃时,反应的平衡常数K=2.25
D. 乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2