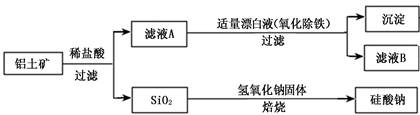
题目内容
下列有关物质的性质和该性质的应用均正确的是
| A.铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 |
| B.二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| C.常温下浓硫酸能与铝发生钝化,可在常温下用铝制贮藏贮运浓硫酸 |
| D.二氧化氯具有还原性,可用于自来水的杀菌消毒 |
C
解析试题分析:A、铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块形成原电池铁作负极,加快其腐蚀,错误;B、二氧化硅能与氢氟酸反应,错误;C、常温下浓硫酸能与铝发生钝化,可在常温下用铝制贮藏贮运浓硫酸,正确;D、二氧化氯用于自来水的杀菌消毒是利用其氧化性,错误。
考点:考查金属的腐蚀与防护、元素化合物知识。

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
下列关于硅单质及其化合物的说法正确的是 ①硅是构成一些岩石和矿物的基本元素
①硅是构成一些岩石和矿物的基本元素 ②水泥、玻璃、水晶饰物都是硅酸盐制品
②水泥、玻璃、水晶饰物都是硅酸盐制品 ③高纯度的硅单质广泛用于制作光导纤维
③高纯度的硅单质广泛用于制作光导纤维  ④陶瓷是人类应用很早的硅酸盐材料
④陶瓷是人类应用很早的硅酸盐材料
| A.①② | B.②③ | C.①④ | D.③④ |
光具有能量,能影响很多反应。下列反应中,受光照影响显著的是
| A.乙醇与乙酸的酯化反应 | B.甲烷与氧气的反应 |
| C.铁与氯气的反应 | D.次氯酸的分解 |
两种大气污染物NO2和SO2在一定条件下可发生如下反应:NO2 + SO2 NO + SO3,在体积为VL的密闭容器中通入amolNO2和bmolSO2,反应后容器内硫原子和氧原子的个数比为( )
NO + SO3,在体积为VL的密闭容器中通入amolNO2和bmolSO2,反应后容器内硫原子和氧原子的个数比为( )
A. | B.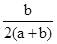 | C. | D.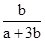 |
在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁、硫酸铝和硫酸铁溶液,这种试剂是( )
| A.NaOH | B.NH3·H2O | C.AgNO3 | D.BaCl2 |
相同质量的铜片分别与过量的体积相同的浓硝酸、稀硝酸反应。二者比较,相等的是
① 铜片消耗完所需时间;② 反应生成的气体体积(标准状况);③ 反应中氧化剂得到的电子总数;④ 反应后溶液中铜离子的浓度
| A.①③ | B.②④ | C.③④ | D.只有① |
海水是巨大的资源宝库,下列关于海水综合利用的说法错误的是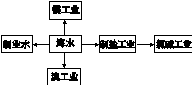
| A.海水制淡水主要有蒸馏法、电渗析法、离子交换法等 |
| B.海水制盐、发展氯碱工业都是发生物理变化 |
| C.海水提溴过程中先通入Cl2将溴离子氧化为溴单质 |
| D.工业上用电解熔融MgCl2的方法制取金属镁 |
一定条件下磷与干燥氯气反应,若0.25 g磷消耗掉314 mL氯气(标准状况),则产物中PCl3与PCl5的物质的量之比接近于( )
| A.3∶1 | B.5∶3 | C.2∶3 | D.1∶2 |