题目内容
相同物质的量浓度的(NH4)3PO4、(NH4)2HPO4和NH4H2PO4溶液各200mL,与物质的量浓度为0.2mol/L的氢氧化钠溶液完全反应所需要的体积比为( )
分析:体积相同、物质的量浓度相同的(NH4)3PO4、(NH4)2HPO4和NH4H2PO4溶液中各溶质的物质的量相等,与NaOH溶液分别发生反应:(NH4)3PO4+3NaOH=Na3PO4+3NH3?H2O、(NH4)2HPO4+3NaOH=Na3PO4+H2O+2NH3?H2O、NH4H2PO4+3NaOH=Na3PO4+2H2O+NH3?H2O,由方程式可知消耗的NaOH的物质的量相等,再根据v=
进行判断.
| n |
| c |
解答:解:体积相同、物质的量浓度相同的(NH4)3PO4、(NH4)2HPO4和NH4H2PO4溶液中各溶质的物质的量相等,与NaOH溶液分别发生反应:(NH4)3PO4+3NaOH=Na3PO4+3NH3?H2O、(NH4)2HPO4+3NaOH=Na3PO4+H2O+2NH3?H2O、NH4H2PO4+3NaOH=Na3PO4+2H2O+NH3?H2O,由方程式可知消耗的NaOH的物质的量相等,NaOH的浓度相同,故消耗NaOH溶液的体积相等,即三者与物质的量浓度为0.2mol/L的氢氧化钠溶液完全反应所需要的体积比为1:1:1,
故选C.
故选C.
点评:本题考查物质的量浓度有关计算,难度不大,清楚发生的反应式解题的关键,注意利用方程式进行计算.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
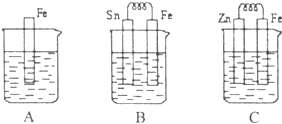 I.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
I.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.