题目内容
在200℃时,将a mol H2(g)和b mol Br2(g)充入到体积为1L的密闭容器中,发生反应:Br2(g)+H2(g)?2HBr(g).
(1)反应刚开始时,由于c(H2)= ,而c (HBr)= ,所以v正最大,而v逆最小为零;
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(Br2) ,
而c(HBr) ,从而化学反应速率v正 ,而v逆 ;(填“增大”、“减小”或“不变”)
(3)当反应进行到v正与v逆 时,此可逆反应就达到了平衡,若保持外界条件不变时,反应混合物中各组分百分含量都将 .
(4)保持容器内气体压强不变,向其中加入a mol H2(g)和b mol Br2(g),反应速率 (填“增大”、“减小”或“不变”)理由是 .
(1)反应刚开始时,由于c(H2)=
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(Br2)
而c(HBr)
(3)当反应进行到v正与v逆
(4)保持容器内气体压强不变,向其中加入a mol H2(g)和b mol Br2(g),反应速率
分析:(1)反应刚开始时,反应物浓度最大,生成物浓度最小;
(2)随着反应的进行,反应物减少,生成物增加,根据浓度变化分析速率变化;
(3)当v正=v逆达到平衡状态;
(4)保持容器内气体压强不变,向其中加入a mol H2(g)和b mol Br2(g),浓度不变,速率不变.
(2)随着反应的进行,反应物减少,生成物增加,根据浓度变化分析速率变化;
(3)当v正=v逆达到平衡状态;
(4)保持容器内气体压强不变,向其中加入a mol H2(g)和b mol Br2(g),浓度不变,速率不变.
解答:解:(1)反应刚开始时,反应物浓度最大,生成物浓度最小,即反应刚开始时,c(H2)=amol/L,而c (HBr)=0mol/L,
故答案为:amol/L;0mol/L;
(2)随着反应的进行,反应物减少,生成物增加,所以反应混合物中各组分浓度的变化趋势为c(Br2)减小,而c(HBr) 增大,则化学反应速率v正减小,而v逆 增大;故答案为:减小;增大;减小;增大;
(3)当v正=v逆达到平衡状态,若保持外界条件不变时,反应混合物中各组分百分含量都将不变,故答案为:相等;不变;
(4)保持容器内气体压强不变,向其中加入a mol H2(g)和b mol Br2(g),反应物的浓度不变,速率不变,故答案为:不变;反应物浓度没有变.
故答案为:amol/L;0mol/L;
(2)随着反应的进行,反应物减少,生成物增加,所以反应混合物中各组分浓度的变化趋势为c(Br2)减小,而c(HBr) 增大,则化学反应速率v正减小,而v逆 增大;故答案为:减小;增大;减小;增大;
(3)当v正=v逆达到平衡状态,若保持外界条件不变时,反应混合物中各组分百分含量都将不变,故答案为:相等;不变;
(4)保持容器内气体压强不变,向其中加入a mol H2(g)和b mol Br2(g),反应物的浓度不变,速率不变,故答案为:不变;反应物浓度没有变.
点评:本题综合考查反应速率的影响因素,注意浓度、温度以及压强对反应速率的影响,难度不大,注意相关基础知识的积累.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
 2HBr(g)。
2HBr(g)。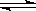 2HI(g)。
2HI(g)。 2HBr(g)。
2HBr(g)。