题目内容
将过量的铜置入一定量的浓硝酸中,微热,充分反应后,放出1.12L气体(标准状况下),试回答下列问题:
(1)反应放出的气体中,含有______和______(写化学式).
(2)完全反应后,所得溶液中的溶质是______.
(3)写出反应过程其中1个化学反应的化学方程式:______.
(4)整个反应过程中,被还原的HNO3总的物质的量是______mol.
解:(1)将过量的铜置入一定量的浓硝酸中,微热,充分反应后,随销售反应浓度变稀,所以放出1.12L气体为一氧化氮和二氧化氮气体,
故答案为:NO;NO2;
(2)铜和稀硝酸、浓硝酸反应,铜内硝酸氧化为硝酸铜,生成溶液中为硝酸铜溶液,故答案为:Cu(NO3)2
(3)铜和稀硝酸、浓硝酸反应生成溶液中溶质为硝酸铜溶液;铜和浓硝酸反应生成硝酸铜、二氧化氮和水,稀硝酸和铜反应生成硝酸铜、一氧化氮和水,反应的化学方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;或3Cu+8HNO3(浓)=3Cu(NO3)2+2NO2↑+4H2O,
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;或3Cu+8HNO3(浓)=3Cu(NO3)2+2NO2↑+4H2O;
(4)将过量的铜置入一定量的浓硝酸中,微热,充分反应后,放出1.12L气体(标准状况下),被还原硝酸生成一氧化氮和二氧化氮,氮元素物质的量相同,所以被还原的硝酸物质的量等于一氧化氮和二氧化氮混合气体物质的量=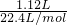 =0.05mol,故答案为:0.05.
=0.05mol,故答案为:0.05.
分析:(1)将过量的铜置入一定量的浓硝酸中,微热,充分反应后,随销售反应浓度变稀,所以放出1.12L气体为一氧化氮和二氧化氮气体;
(2)铜和稀硝酸、浓硝酸反应生成溶液中为硝酸铜溶液;
(3)依据氧化还原反应电子守恒配平写出化学方程式,铜和浓硝酸反应生成硝酸铜、二氧化氮和水,稀硝酸和铜反应生成硝酸铜、一氧化氮和水;
(4)依据氮元素守恒分析计算,化合价变化的被还原.
点评:本题考查硝酸性质的应用,主要是氧化还原反应的计算应用和产物判断,题目较简单.
故答案为:NO;NO2;
(2)铜和稀硝酸、浓硝酸反应,铜内硝酸氧化为硝酸铜,生成溶液中为硝酸铜溶液,故答案为:Cu(NO3)2
(3)铜和稀硝酸、浓硝酸反应生成溶液中溶质为硝酸铜溶液;铜和浓硝酸反应生成硝酸铜、二氧化氮和水,稀硝酸和铜反应生成硝酸铜、一氧化氮和水,反应的化学方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;或3Cu+8HNO3(浓)=3Cu(NO3)2+2NO2↑+4H2O,
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;或3Cu+8HNO3(浓)=3Cu(NO3)2+2NO2↑+4H2O;
(4)将过量的铜置入一定量的浓硝酸中,微热,充分反应后,放出1.12L气体(标准状况下),被还原硝酸生成一氧化氮和二氧化氮,氮元素物质的量相同,所以被还原的硝酸物质的量等于一氧化氮和二氧化氮混合气体物质的量=
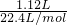 =0.05mol,故答案为:0.05.
=0.05mol,故答案为:0.05.分析:(1)将过量的铜置入一定量的浓硝酸中,微热,充分反应后,随销售反应浓度变稀,所以放出1.12L气体为一氧化氮和二氧化氮气体;
(2)铜和稀硝酸、浓硝酸反应生成溶液中为硝酸铜溶液;
(3)依据氧化还原反应电子守恒配平写出化学方程式,铜和浓硝酸反应生成硝酸铜、二氧化氮和水,稀硝酸和铜反应生成硝酸铜、一氧化氮和水;
(4)依据氮元素守恒分析计算,化合价变化的被还原.
点评:本题考查硝酸性质的应用,主要是氧化还原反应的计算应用和产物判断,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目