题目内容
下列叙述中,错误的是( )
| A、H2S、H2O、HF的稳定性依次增强 |
| B、RbOH、KOH、Mg(OH)2的碱性依次减弱 |
| C、Ca、Mg、Na的还原性依次减弱 |
| D、H2SiO3、H2CO3、H2SO4的酸性依次增强 |
考点:非金属在元素周期表中的位置及其性质递变的规律,金属在元素周期表中的位置及其性质递变的规律
专题:元素周期律与元素周期表专题
分析:A、非金属性越强,则氢化物的稳定性越强;
B、金属性越强,则最高价氧化物的水化物的碱性越强;
C、金属性越强,则单质的还原性越强;
D、非金属性越强,则最高价氧化物的水化物的酸性越强.
B、金属性越强,则最高价氧化物的水化物的碱性越强;
C、金属性越强,则单质的还原性越强;
D、非金属性越强,则最高价氧化物的水化物的酸性越强.
解答:
解:A、非金属性越强,则氢化物的稳定性越强,非金属性:S<O<F,则H2S、H2O、HF的稳定性依次增强,故A正确;
B、金属性越强,则最高价氧化物的水化物的碱性越强,金属性:Rb>K>Mg,则RbOH、KOH、Mg(OH)2的碱性依次减弱,故B正确;
C、金属性越强,则单质的还原性越强,金属性:Ca>Na>Mg,则Ca、Na、Mg的还原性依次减弱,故C错误;
D、非金属性越强,则最高价氧化物的水化物的酸性越强,非金属性:Si<C<S,则H2SiO3、H2CO3、H2SO4的酸性依次增强,故D正确;
故选C.
B、金属性越强,则最高价氧化物的水化物的碱性越强,金属性:Rb>K>Mg,则RbOH、KOH、Mg(OH)2的碱性依次减弱,故B正确;
C、金属性越强,则单质的还原性越强,金属性:Ca>Na>Mg,则Ca、Na、Mg的还原性依次减弱,故C错误;
D、非金属性越强,则最高价氧化物的水化物的酸性越强,非金属性:Si<C<S,则H2SiO3、H2CO3、H2SO4的酸性依次增强,故D正确;
故选C.
点评:本题考查了元素周期律,主要考查了金属元素和非金属元素性质的递变规律,题目难度不大

练习册系列答案
相关题目
(实验班做)下列说法正确的是( )
①同系物的化学性质相似
②组成可以用相同通式表示的有机物一定是同系物.
③各元素的质量分数相同的物质一定是同系物.
①同系物的化学性质相似
②组成可以用相同通式表示的有机物一定是同系物.
③各元素的质量分数相同的物质一定是同系物.
| A、①②③④ | B、①② |
| C、②③ | D、只有① |
最近,美国LawreceLiremore国家实验室(LLNL)的V.Lota.C.S.Yoo和Cynn成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,下列关于CO2的原子晶体说法正确的是( )
| A、CO2的原子晶体中存在范德华力,每1mol CO2原子晶体中含有2NAπ键 |
| B、在一定条件下,CO2原子晶体转化为分子晶体CO2是物理变化 |
| C、熔点:金刚石>氯化钠>原子晶体CO2 |
| D、在CO2的原子晶体中,每个C原子周围结合4个O原子,每个O原子与两个C原子相结合 |
下列关于有机化合物的说法正确的是( )
| A、乙酸和乙酸乙酯可用Na2CO3溶液加以区别 |
| B、汽油、乙烯均为石油分馏产品 |
| C、可以用分液的方法分离硝基苯和苯 |
| D、有机化合物都能燃烧 |
下列关于复合材料的说法正确的是( )
| A、将不同性质的材料经简单混合便成复合材料 |
| B、合金就是复合材料 |
| C、复合材料中的各部分作用相同 |
| D、复合材料由两种或两种以上不同性质的材料经特殊加工而制成的 |
a是一种难溶于水的氧化物,能熔于熔融态的烧碱,生成易溶于水的化合物b,将少量b溶液滴入盐酸中,最终能生成一种白色的胶状沉淀,则a为( )
| A、CO2 |
| B、SiO2 |
| C、Al2O3 |
| D、MgO |
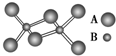 某无机化合物的二聚分子结构如图,该分子中A、B两种元素都是第三周期的元素,分子中所有原子最外层都达到8电子稳定结构.下列关于该化合物的说法不正确的是( )
某无机化合物的二聚分子结构如图,该分子中A、B两种元素都是第三周期的元素,分子中所有原子最外层都达到8电子稳定结构.下列关于该化合物的说法不正确的是( )| A、化学式是Al2Cl6 |
| B、不存在离子键和非极性共价键 |
| C、在固态时所形成的晶体是分子晶体 |
| D、是离子化合物,在熔融状态下能导电 |