题目内容
【题目】铁是一种非常重要的金属。
(1)中科院兰州化学物理研究所用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,反应过程如图。催化剂中添加助剂Na、K、Cu(也起催化作用)后可改变反应的选择性。
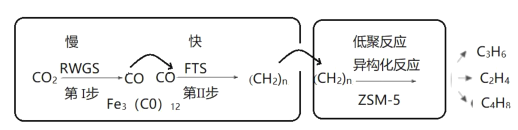
下列说法正确的是___。
A.第ⅰ步反应的活化能低于第ⅱ步
B.第ⅰ步所发生的反应为:CO2+H2![]() CO+H2O
CO+H2O
C.Fe3(CO)12/ZSM-5使CO2加氢合成低碳烯烃的ΔH减小
D.保持其他条件不变,添加不同助剂后各反应的平衡常数不变
加入助剂K能提高单位时间内乙烯产量的根本原因是___。
(2)纳米铁是重要的储氢材料,可用反应Fe(s)+5CO(g)![]() Fe(CO)5(g)制得。在1L恒容密闭容器中加入足量铁粉和0.24mol CO,在T1、T2不同温度下进行反应,测得c(CO)与温度、时间的关系如图所示。
Fe(CO)5(g)制得。在1L恒容密闭容器中加入足量铁粉和0.24mol CO,在T1、T2不同温度下进行反应,测得c(CO)与温度、时间的关系如图所示。
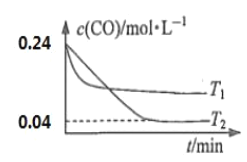
①T1___T2,△H___0(填“>”或“<”)
②已知:标准平衡常数Kθ=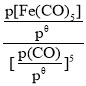 ,其中pθ为标准压强(1×105Pa),p[Fe(CO)5]、p(CO)为各组分的平衡分压。T2温度下,平衡时体系的压强为p,反应的标准平衡常数Kθ=___(用含p的最简式表示)
,其中pθ为标准压强(1×105Pa),p[Fe(CO)5]、p(CO)为各组分的平衡分压。T2温度下,平衡时体系的压强为p,反应的标准平衡常数Kθ=___(用含p的最简式表示)
(3)高铁酸钾(K2FeO4)被称为“绿色化学”净水剂,在酸性至弱碱性条件下不稳定。
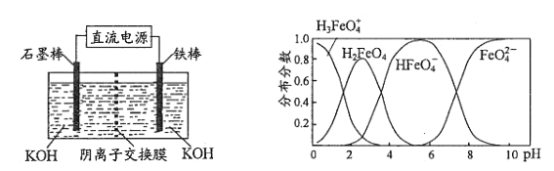
①电解法可制得K2FeO4,装置如图,若转移6mol电子则隔膜右边溶液增重___g。
②K2FeO4在水解过程中铁元素形成的微粒分布分数与pH的关系如图所示,向pH=6的溶液中加入KOH溶液,发生反应的离子方程式为___。
(4)复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解制氢气,原理如下:
①MnFe2O4(s)=MnFe2O(4-x)(s)+![]() O2(g)△H1
O2(g)△H1
②MnFe2O(4-x)(s)+xH2O(g)=MnFe2O4(s)+xH2(g)△H2
③2H2O(g)=2H2(g)+O2(g)△H3
则:△H3与△H1、△H2的关系为___。
【答案】BD 降低生成乙烯的反应所需要的活化能,加快乙烯生成速率 > < ![]() 158g
158g ![]()
![]()
![]()
![]()
【解析】
(1)A.由于一般活化能越低,反应速率越快,故第ⅰ步反应的活化能高低于第ⅱ步,故A错误;
B.根据反应过程图可知,第ⅰ步所发生的反应为:CO2+H2![]() CO+H2O,故B正确;
CO+H2O,故B正确;
C.反应热ΔH只与反应物和生成物的状态有关,而与反应过程无关,故Fe3(CO)12/ZSM-5使CO2加氢合成低碳烯烃的ΔH不变,故C错误;
D.化学平衡常数仅是温度的函数,温度不变,化学平衡常数不变,故D正确;
故答案为:BD;
加入助剂K能提高单位时间内乙烯产量即提高了生成乙烯的反应速率,故其根本原因是降低生成乙烯的反应所需要的活化能,加快乙烯生成速率,故答案为:降低生成乙烯的反应所需要的活化能,加快乙烯生成速率;
(2)①由图中可知:T1条件下先达到平衡,故T1时反应速率快,故T1>T2,又温度越高,CO的浓度越高,即升高温度,平衡逆向移动,故△H<0,故答案为:>;<;![]()
②由图像中可知T2温度下,c(CO)=0.04mol/L,经过计算可以得c[Fe(CO)5]=0.04mol/L,又知气体的压强之比等于物质的量之比,平衡时体系的压强为p,故p[Fe(CO)5]=p(CO)=![]() ,反应的标准平衡常数
,反应的标准平衡常数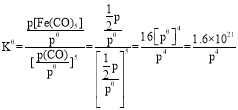 ,故答案为:
,故答案为:![]() ;
;
(3)①右侧为阳极,碱性条件下Fe失电子转化为![]() 离子,阳极电极反应式为:Fe+8OH--6e-=
离子,阳极电极反应式为:Fe+8OH--6e-=![]() +4H2O,若转移6mol电子则隔膜右边溶液增重为1mol Fe和从左侧进入的6mol OH-,即
+4H2O,若转移6mol电子则隔膜右边溶液增重为1mol Fe和从左侧进入的6mol OH-,即![]() ,故答案为158g;
,故答案为158g;
②根据K2FeO4在水解过程中铁元素形成的微粒分布分数与pH的关系图所示,可知pH=6时溶液中主要是![]() ,故加入KOH溶液,发生反应的离子方程式为
,故加入KOH溶液,发生反应的离子方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(4)由反应①②可以推断出反应③=![]() (反应①+反应②),故
(反应①+反应②),故 ![]() ,故答案为:
,故答案为: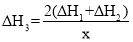 。
。![]()