题目内容
部分弱酸的电离平衡常数如下表:
下列选项错误的是
A.2CN-+H2O+CO2→2HCN+CO32-
B.2HCOOH+CO32-→2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
A.2CN-+H2O+CO2→2HCN+CO32-
B.2HCOOH+CO32-→2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
AD
根据电离常数可知酸性:HCOOH > H2CO3> HCN > HCO3-,因此A错误,B正确;等体积、等pH的HCOOH和HCN所含溶质,HCN多,则中和时消耗NaOH的量多,C正确;根据电荷守恒:n(HCOO-)+n(OH-)=n(Na+)+n(H+), n(CN-)+n(OH-)=n(Na+)+n(H+),即离子总数是n(Na+)+n(H+)的2倍,而NaCN的水解程度大,即NaCN溶液中的n(OH-)大,n(H+)小,D错误。
【考点定位】本题考查酸性强弱,离子浓度比较、中和反应等。
【考点定位】本题考查酸性强弱,离子浓度比较、中和反应等。

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目



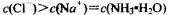
 、H+
、H+ 、Cl-
、Cl-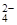 、OH-
、OH-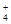 、Cl- 、NO
、Cl- 、NO
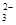 、Na+、[Al(OH)]4-
、Na+、[Al(OH)]4-  、SO
、SO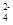
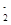 、S2-、SO
、S2-、SO