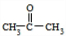题目内容
石油和煤是化工原料的重要来源,从石油中获得A,是工业上生产A的主要途径,A可用作植物生长调节剂.从煤焦油中可获得烃B,B中碳,氢两种元素质量比为12:1,且B是常见的有机溶剂.工业上可以通过下面的途径获得A、B.(1)由煤得到煤焦油的方法称为 ;由石蜡油获得A的石油化工称为 .
(2)A的结构简式 ;B的分子式 .
(3)写出满足下列要求的化学方程式(注明反应条件):
①A发生加聚反应; ;
②B发生取代反应 (写一个满足条件的方程式即可).
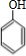
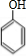
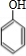
(4)用B和丙烯可以生产两种重要的化工原料:苯酚(
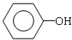 )和丙酮(CH3COCH3).生产流程如下:
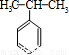
)和丙酮(CH3COCH3).生产流程如下:已知反应①是加成反应,C的一氯代物有5种,则C的结构简式为 ;反应②的化学方程式为 .
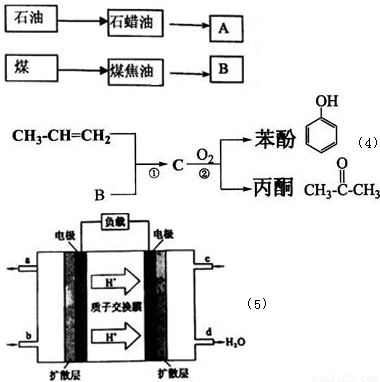
(5)煤液化后在催化剂作用下可合成甲醇(CH3OH).2009年10月中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破.甲醇燃料电池的工作原理如图所示,在酸性溶液中甲醇与氧气作用生成水和二氧化碳.
①该电池工作时,b口通入的物质为 .
②该电池负极的电极反应式为: .放电时,H+移向电池的 (填“正”或“负”)极.
③工作一段时间后,当6.4g甲醇完全反应生成CO2时,有 NA个电子转移.
【答案】分析:(1)(2)(3)从石油中获得A,是工业上生产A的主要途径,A可用作植物生长调节剂,A为乙烯(CH2=CH2),从煤焦油中可获得烃B,B中碳、氢两种元素质量比为12:1,B分子中C、H原子数目之比为 :
: =1:1,且B是常见的有机溶剂,B为苯(C6H6),据此解答;
=1:1,且B是常见的有机溶剂,B为苯(C6H6),据此解答;
(4)苯和丙烯的反应是加成反应,结合C的氧化产物可知,丙烯中的C=C双键中一个键断裂,与苯发生加成反应生成C,C的一氯代物有5种,苯环上有3种一氯代物,故侧链上有2种一氯代物,故C为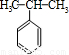 ,据此解答;
,据此解答;
(5)①根据装置可以知道d出生成大量的水,所以e口是通入的氧气,故b口通入的是CH3OH;
②乙醇发生氧化反应,在负极放电,总反应式为2CH3OH+3O2=2CO2+4H2O,正极电极反应为:3O2+12e-+12H+=6H2O,两式相减可得负极的电极反应式,注意电子相等.放电时,H+移向电池的正极;
③根据n=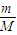 计算甲醇的物质的量,根据反应2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g),当消耗甲醇2mol时,转移电子为12mol,据此计算注意电子数目.
计算甲醇的物质的量,根据反应2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g),当消耗甲醇2mol时,转移电子为12mol,据此计算注意电子数目.
解答:解:从石油中获得A,是工业上生产A的主要途径,A可用作植物生长调节剂,A为乙烯(CH2=CH2),从煤焦油中可获得烃B,B中碳、氢两种元素质量比为12:1,B分子中C、H原子数目之比为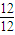 :
: =1:1,且B是常见的有机溶剂,B为苯(C6H6),
=1:1,且B是常见的有机溶剂,B为苯(C6H6),
(1)由煤得到煤焦油的方法称为干馏,由石蜡油获得A的石油化工称为裂解,故答案为:干馏,裂解;
(2)A的结构简式为CH2=CH2;B的分子式为C6H6,故答案为:CH2=CH2;C6H6;
(3)①CH2=CH2发生加聚反应生成聚乙烯,反应方程式为:nCH2=CH2
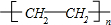 ,
,
故答案为:nCH2=CH2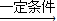
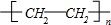 ;
;
②苯与液溴在FeBr3作催化剂发生取代反应生成溴苯,反应方程式为: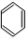 +Br2
+Br2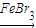
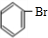 +HBr,
+HBr,
故答案为: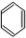 +Br2
+Br2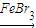
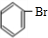 +HBr;
+HBr;
(4)苯和丙烯的反应是加成反应,结合C的氧化产物可知,丙烯中的C=C双键中一个键断裂,与苯发生加成反应生成C,C的一氯代物有5种,苯环上有3种一氯代物,故侧链上有2种一氯代物,故C为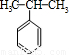 ,反应②的化学方程式为:
,反应②的化学方程式为: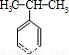 +O2
+O2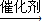
 +
+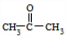 ,
,
故答案为: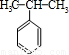 ,
, +O2
+O2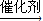
 +
+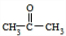 ;
;
(5)①根据装置可以知道d出生成大量的水,所以e口是通入的氧气,故b口通入的是CH3OH,故答案为:CH3OH;
②乙醇发生氧化反应,在负极放电,总反应式为2CH3OH+3O2=2CO2+4H2O,正极电极反应为:3O2+12e-+12H+=6H2O,两式相减可得负极的电极反应式为2CH3OH-12e-+2H2O=2CO2+12H+,即CH3OH-6e-+H2O=CO2+6H+.放电时,H+移向电池的正极,
故答案为:CH3OH-6e-+H2O=CO2+6H+,正;
③甲醇的物质的量为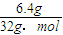 =0.2mol,根据反应2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g),当消耗甲醇2mol时,转移电子为12mol,所以当6.4g甲醇完全反应生成CO2时,转移电子是
=0.2mol,根据反应2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g),当消耗甲醇2mol时,转移电子为12mol,所以当6.4g甲醇完全反应生成CO2时,转移电子是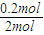 ×12mol=1.2mol,转移电子数目是1.2NA,故答案为:1.2.
×12mol=1.2mol,转移电子数目是1.2NA,故答案为:1.2.
点评:本题考查有机物的推断与合成、原电池原理等,难度不大,(5)中电极反应式的书写是易错点、难点,注意利用总反应式减去正极反应式可得负极电极反应式.
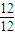 :
: =1:1,且B是常见的有机溶剂,B为苯(C6H6),据此解答;
=1:1,且B是常见的有机溶剂,B为苯(C6H6),据此解答;(4)苯和丙烯的反应是加成反应,结合C的氧化产物可知,丙烯中的C=C双键中一个键断裂,与苯发生加成反应生成C,C的一氯代物有5种,苯环上有3种一氯代物,故侧链上有2种一氯代物,故C为
 ,据此解答;
,据此解答;(5)①根据装置可以知道d出生成大量的水,所以e口是通入的氧气,故b口通入的是CH3OH;
②乙醇发生氧化反应,在负极放电,总反应式为2CH3OH+3O2=2CO2+4H2O,正极电极反应为:3O2+12e-+12H+=6H2O,两式相减可得负极的电极反应式,注意电子相等.放电时,H+移向电池的正极;
③根据n=
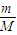 计算甲醇的物质的量,根据反应2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g),当消耗甲醇2mol时,转移电子为12mol,据此计算注意电子数目.
计算甲醇的物质的量,根据反应2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g),当消耗甲醇2mol时,转移电子为12mol,据此计算注意电子数目.解答:解:从石油中获得A,是工业上生产A的主要途径,A可用作植物生长调节剂,A为乙烯(CH2=CH2),从煤焦油中可获得烃B,B中碳、氢两种元素质量比为12:1,B分子中C、H原子数目之比为
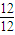 :
: =1:1,且B是常见的有机溶剂,B为苯(C6H6),
=1:1,且B是常见的有机溶剂,B为苯(C6H6),(1)由煤得到煤焦油的方法称为干馏,由石蜡油获得A的石油化工称为裂解,故答案为:干馏,裂解;
(2)A的结构简式为CH2=CH2;B的分子式为C6H6,故答案为:CH2=CH2;C6H6;
(3)①CH2=CH2发生加聚反应生成聚乙烯,反应方程式为:nCH2=CH2
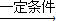
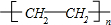 ,
,故答案为:nCH2=CH2
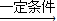
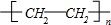 ;
;②苯与液溴在FeBr3作催化剂发生取代反应生成溴苯,反应方程式为:
 +Br2
+Br2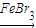
 +HBr,
+HBr,故答案为:
 +Br2
+Br2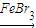
 +HBr;
+HBr;(4)苯和丙烯的反应是加成反应,结合C的氧化产物可知,丙烯中的C=C双键中一个键断裂,与苯发生加成反应生成C,C的一氯代物有5种,苯环上有3种一氯代物,故侧链上有2种一氯代物,故C为
 ,反应②的化学方程式为:
,反应②的化学方程式为: +O2
+O2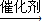
 +
+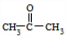 ,
,故答案为:
 ,
, +O2
+O2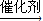
 +
+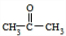 ;
;(5)①根据装置可以知道d出生成大量的水,所以e口是通入的氧气,故b口通入的是CH3OH,故答案为:CH3OH;
②乙醇发生氧化反应,在负极放电,总反应式为2CH3OH+3O2=2CO2+4H2O,正极电极反应为:3O2+12e-+12H+=6H2O,两式相减可得负极的电极反应式为2CH3OH-12e-+2H2O=2CO2+12H+,即CH3OH-6e-+H2O=CO2+6H+.放电时,H+移向电池的正极,
故答案为:CH3OH-6e-+H2O=CO2+6H+,正;
③甲醇的物质的量为
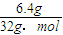 =0.2mol,根据反应2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g),当消耗甲醇2mol时,转移电子为12mol,所以当6.4g甲醇完全反应生成CO2时,转移电子是
=0.2mol,根据反应2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g),当消耗甲醇2mol时,转移电子为12mol,所以当6.4g甲醇完全反应生成CO2时,转移电子是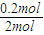 ×12mol=1.2mol,转移电子数目是1.2NA,故答案为:1.2.
×12mol=1.2mol,转移电子数目是1.2NA,故答案为:1.2.点评:本题考查有机物的推断与合成、原电池原理等,难度不大,(5)中电极反应式的书写是易错点、难点,注意利用总反应式减去正极反应式可得负极电极反应式.

练习册系列答案
相关题目
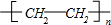
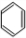 +Br2
+Br2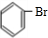 +HBr
+HBr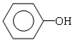 )和丙酮(CH3COCH3).生产流程如下:
)和丙酮(CH3COCH3).生产流程如下: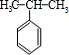
 +
+