题目内容
【题目】(1)在容积为1.00L的容器中,通入一定量的N2O4发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
①反应的△H_______0(填“大于”“小于”);
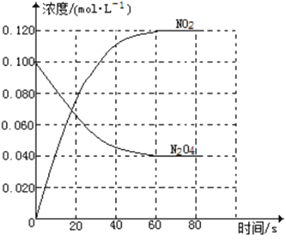
②100℃时,体系中各物质浓度随时间变化如右图所示。在0~60s时段,反应速率v(N2O4)为_________molL-1s-1反应的平衡常数K为__________。
(2)在恒容密闭容器中通入X 并发生反应:2X(g) = Y(g);温度T1、T2下X的物质的最浓度c(X)随时间t 变化的曲线如图所示。
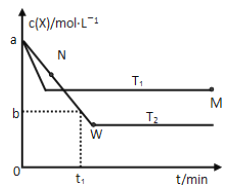
①T1____T2 (填“大于”或“小于”)。
②M点的正反应速率V正____N点的逆反应速率V逆(填“大于”,“小于”或“等于”)。
(3)CuBr2分解的热化学方程式为:2CuBr2(s)=2CuBr(s) + Br2(g) ΔH= + 105. 4kJ/mol。在密闭容器中将过量CuBr2于487K下加热分解,平衡时p(Br2)为4.66×103Pa。
①如反应体系的体积不变,提高反应温度,则p(Br2)将会_______(填“增大”、“不变”或“减小”)。
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为_______。
【答案】 大于 0.001 0.36mol/L 大于 大于 增大 2.33×103Pa,4.66×103Pa
【解析】(1)①随温度升高,混合气体的颜色变深,平衡正向移动,说明该反应的正反应是吸热反应,则反应的△H大于0;②0~60s时段,N2O4浓度变化为:
0.100mol/L-0.040mol/L=0.060mol/L,v(N2O4)=0.060mol/L/60s=0.0010 molL-1s-1,
K= c2(NO2)/ c(N2O4)=( 0.120mol/L)2/0.040mol/L=0.36mol/L。
(2)①根据图像可知,T1达到平衡时时间比T2时达平衡时间少,说明反应速率快,则T1大于T2;②因T1>T2,vM正=vM逆> vN逆;
(3)①CuBr2分解的热化学方程式为:2CuBr2(s)=2CuBr(s) + Br2(g) ΔH= + 105. 4kJ/mol,正反应是吸热反应,提高反应温度,平衡正向移动,因反应体系的体积不变,则气体压强增大;②体积增大一倍时,p(Br2)降为原来的一半,即2.33×103Pa,压强减小使平衡向气体体积数增大的方向移动,因而会大于2.33×103Pa;则p(Br2)的变化范围为(2.33×103Pa,4.66×103Pa)

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案【题目】下表物质与其所含化学键类型、所属化合物类型完全正确的一组是
选 项 | A | B | C | D |
物 质 | CO2 | MgCl2 | HCl | NaOH |
所含化学键型 | 共价键 | 离子键、共价键 | 离子键 | 离子键、共价键 |
所属化合物型 | 共价化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
A. A B. B C. C D. D
【题目】表中关于物质分类的正确组合是
类别 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 |
A | CO2 | SiO2 | H2SO4 | Na2CO3 | NaHCO3 |
B | CO | Na2O | HCl | NaOH | NaCl |
C | SO2 | Na2O2 | CH3COOH | KOH | CaF2 |
D | SO3 | CaO | HNO3 | Ca(OH)2 | CaCO3 |
A. AB. BC. CD. D