题目内容
某微粒的结构示意图为 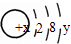 试回答:
试回答:
(1)当x-y=10时,该粒子为 (选填“原子”或“阳离子”、“阴离子”);
(2)当y=8时,该粒子可能是(用化学式表示,任填3种) 、 、 ;
(3)请写出工业上制取y=7元素对应单质时的离子方程式: .
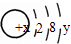 试回答:
试回答:(1)当x-y=10时,该粒子为
(2)当y=8时,该粒子可能是(用化学式表示,任填3种)
(3)请写出工业上制取y=7元素对应单质时的离子方程式:
分析:(1)依据原子核电荷数=质子数=海外电子数计算分析;
(2)依据原子核电荷数=质子数=核外电子数,原子得失电子可能形成8电子稳定结构,稀有气体是8电子稳定结构;
(3)y=7元素对应单质为Cl2,依据制备氯气反应原理写出.
(2)依据原子核电荷数=质子数=核外电子数,原子得失电子可能形成8电子稳定结构,稀有气体是8电子稳定结构;
(3)y=7元素对应单质为Cl2,依据制备氯气反应原理写出.
解答:解:(1)x-y=10时,说明x=10+y,符合核电荷数=质子数=核外电子数,是原子,故答案为:原子;
(2)原子核电荷数=质子数=核外电子数,原子得失电子可能形成8电子稳定结构,稀有气体是8电子稳定结构;符合结构的原子为Ar,阳离子为K+、Ca2+,阴离子为S2-Cl-等,故答案为:S2-;Cl-;Ar;
(3)y=7元素对应单质为Cl2,依据制备氯气是用二氧化锰和浓盐酸加热反应生成;反应的离子方程式为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O.
(2)原子核电荷数=质子数=核外电子数,原子得失电子可能形成8电子稳定结构,稀有气体是8电子稳定结构;符合结构的原子为Ar,阳离子为K+、Ca2+,阴离子为S2-Cl-等,故答案为:S2-;Cl-;Ar;
(3)y=7元素对应单质为Cl2,依据制备氯气是用二氧化锰和浓盐酸加热反应生成;反应的离子方程式为:MnO2+4H++2Cl-
| ||
故答案为:MnO2+4H++2Cl-
| ||
点评:本题考查了原子结构、离子结构的特征分析判断,熟练掌握原子结构的基础知识是解题关键,题目较简单.

练习册系列答案
相关题目
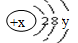 试回答:
试回答: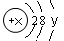 试回答:
试回答: