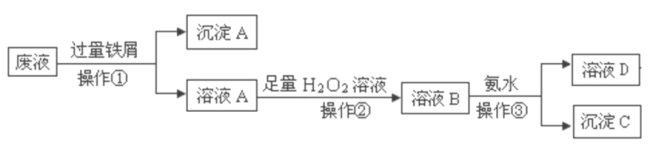
题目内容
【题目】25℃时,如图烧杯中各盛有20mL的溶液。
甲.  0.100mol/L盐酸 乙.
0.100mol/L盐酸 乙.  0.100mol/L氨水 丙.
0.100mol/L氨水 丙.  0.100mol/LNH4Cl
0.100mol/LNH4Cl
(1)甲溶液的pH=_____________。
(2)若将甲全部倒入乙中,所得溶液的pH_____________丙溶液的pH(填“>”、“=”或“<”)。
(3)若将一部分乙倒入丙中,所得的混合溶液呈中性,所得混合溶液中离子浓度大小关系是_____________。
【答案】1 > c(NH4+)=c(Cl-)>c(H+)=c(OH-)
【解析】
(1)0.100mol/L盐酸中c(H+)=0.100mol/L,所以溶液pH=1;
(2)等体积(20mL)等浓度(0.100mol/L)的盐酸和氨水混合得到的溶液为NH4Cl溶液,浓度为0.05mol/L,铵根水解使溶液显酸性;丙为0.100mol/L的NH4Cl,所以丙的酸性较强,所以混合溶液的pH>丙溶液的pH;
(3)溶液中存在电荷守恒c(NH4+)+ c(H+)=c(Cl-)+c(OH-),溶液显中性则c(H+)=c(OH-),水解使微弱的,所以c(NH4+)=c(Cl-)>c(H+)=c(OH-)。

练习册系列答案
相关题目