题目内容
【题目】ClO2气体是一种高效、广谱、安全的杀菌消毒剂,可用NaClO3和草酸(H2C2O4)反应制得。无水草酸100℃可以升华。某学习小组用下图装置模拟工业制取收集ClO2 。

(1)实验时装置A需在60℃~100℃进行的原因是_________,控制所需温度的方法是___________。
(2)电动搅拌棒的作用是_________。装置A中反应产物有Na2CO3、ClO2和CO2等,该反应的化学方程式为___________________。
(3)在装置C中ClO2和NaOH反应生成等物质的量的两种盐,其中一种盐为NaClO2 ,写出反应的离子方程式_________________。
(4)用ClO2处理过的饮用水(pH为5.5~6.5)往往残留少量ClO2和一定量对人体不利的亚氯酸根离子(ClO2-)。
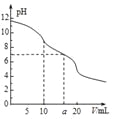
① ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如右图
 所示
所示
② 当pH≤2.0时,ClO2-也能被I-还原成Cl-
③ 2Na2S2O3+I2=Na2S4O6+2NaI
根据上述信息,请补充完整测定饮用水中ClO2-含量的实验方案:
取一定体积的饮用水,加入NaOH溶液调节pH为7.0~8.0; ;再重复上述操作1~2次,计算得出结果。
(实验中需使用的试剂:淀粉溶液、标准Na2S2O3溶液、KI溶液、稀硫酸)
【答案】(1)温度过低,化学反应速率较慢,温度过高草酸升华或分解;水浴加热 ;
(2)将反应物充分混合(或充分反应、或使反应物受热均匀),2NaClO3 + H2C2O4 ![]() Na2CO3 + CO2↑+ 2ClO2↑+ H2O;
Na2CO3 + CO2↑+ 2ClO2↑+ H2O;
(3) 2ClO2 + 2OH-=ClO3-+ ClO2-+ H2O;
(4)加入足量KI溶液,加2滴淀粉溶液;用标准Na2S2O3溶液滴定至终点(或蓝色褪去),记录消耗标准Na2S2O3溶液的体积;加入稀硫酸调节溶液的pH≤2.0;继续用标准Na2S2O3溶液滴定至终点,记录消耗标准Na2S2O3溶液的体积。
【解析】
试题分析:(1)温度小于60℃,化学反应速率降低,大于100℃时,根据信息,无水草酸升华,因此控制温度在60℃~100℃,控制所需温度的方法是水浴加热;
(2)搅拌棒的作用:是混合物混合均匀,加速反应,根据题目,反应物是NaClO3和草酸,生成物是Na2CO3、ClO2、CO2,因此反应方程式为2NaClO3 + H2C2O4 ![]() Na2CO3 + CO2↑+ 2ClO2↑+ H2O;
Na2CO3 + CO2↑+ 2ClO2↑+ H2O;
(3)根据氧化还原反应的规律,有化合价的升高,也有化合价的降低,因为生成两种盐,因此离子反应方程式为:2ClO2 + 2OH-=ClO3-+ ClO2-+ H2O;
(4)加入足量KI溶液,加2滴淀粉溶液;用标准Na2S2O3溶液滴定至终点(或蓝色褪去),记录消耗标准Na2S2O3溶液的体积;加入稀硫酸调节溶液的pH≤2.0;继续用标准Na2S2O3溶液滴定至终点,记录消耗标准Na2S2O3溶液的体积。