题目内容
【题目】按要求填空
(1)Cu元素基态原子的电子排布式为 .
(2)元素N,O,S的第一电离能由大到小排列的顺序为 .
(3)S,Cl组成的一种化合物的分子结构与H2O2相似,则此化合物的结构式为 .
(4)Cu元素与H元素可形成一种红色晶体,其结构如图1,则该化合物的化学式为 .
(5)MgH2是金属氢化物储氢材料,其晶胞结构如图2所示,已知该晶体的密度agcm﹣3 , 则晶胞的体积为cm3[用a、NA表示阿伏加德罗常数]. 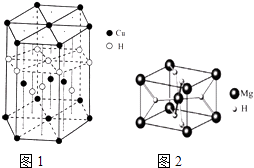
【答案】
(1)1s22s22p63s23p63d104s1或[Ar]3d104s1
(2)N>O>S
(3)Cl﹣S﹣S﹣Cl
(4)CuH
(5)![]()
【解析】解:(1)Cu为29号元素,原子核外有29个电子,根据能量最低原理,其核外电子排布式为:1s22s22p63s23p63d104s1或[Ar]3d104s1 , 所以答案是:1s22s22p63s23p63d104s1或[Ar]3d104s1;(2)N、O元素处于第二周期,且N元素处于第VA族,O元素处于第VIA族,S元素处于第三周期第VIA族,所以这三种元素的第一电离能大小顺序是N>O>S,
所以答案是:N>O>S;(3)S2Cl2分子结构与H2O2相似,S2Cl2分子中氯原子与硫原子之间形成1对共用电子对,硫原子与硫原子之间形成1对共用电子对,所以其结构式为:Cl﹣S﹣S﹣Cl,所以答案是:Cl﹣S﹣S﹣Cl;(4)该晶胞中含有铜原子个数铜原子个数=4+2× ![]() +12×
+12× ![]() =7,H原子个数=1+3+6×
=7,H原子个数=1+3+6× ![]() =7,所以铜原子和氢原子个数比是1:1,则其化学式为CuH,所以答案是:CuH;(5)Mg位于顶点和体心,数目为8×
=7,所以铜原子和氢原子个数比是1:1,则其化学式为CuH,所以答案是:CuH;(5)Mg位于顶点和体心,数目为8× ![]() +1=2,H位于面心,数目为:8×
+1=2,H位于面心,数目为:8× ![]() =4,说明该晶胞中有2个MgH2 , 则晶胞质量为
=4,说明该晶胞中有2个MgH2 , 则晶胞质量为 ![]() g,晶胞体积为:V=
g,晶胞体积为:V= ![]() =
= ![]() cm3 , 所以答案是:
cm3 , 所以答案是: ![]() .
.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案