题目内容
【题目】MgH2和Mg2Cu可用作贮氢材料,MgO可用作炉膛内脱硫脱硝的试剂。
(1)MgH2是一种离子化合物,其电子式为_______________。
(2)Mg2Cu在加压条件下储氢时生成MgH2和MgCu2,该反应的化学方程式为_____________。
(3)已知MgH2的有关热化学方程式如下:
MgH2(s) =Mg(s)+H2(g) △H1=+74.4kJ mol-1;
H2(g)+l/2O2(g)=H2O(g) △H2=-241.8 kJ mol-1;
Mg(s)+l/2O2(g)=MgO(s) △H3=-141.6 KJ mol-1。
①氢化镁燃烧生成氧化镁和水蒸气的热化学方程式为______________。
②MgH2作贮氢材料时,单位贮氢材料释放出氢气的质量随时间的变化如图甲所示,其中温度T1、T2、T3由小到大的顺序为__________________。
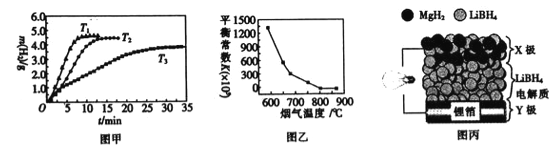
(4)炉膛内脱除 SO2、NO 反应为2MgO(s)+2SO2(g)+2NO(g)![]() 2MgSO4(s)+N2(g) △H =akJ/ mol,其平衡常数与温度的关系如图乙所示。
2MgSO4(s)+N2(g) △H =akJ/ mol,其平衡常数与温度的关系如图乙所示。
①上述反应的平衡常数表达式为K=_________。
②a_________0(填“>”或“,<”)。
(5)全固态锂离子电池的结构如图丙所示,放电时电池反应为2Li+MgH2=Mg+2LiH。放电时,X极的电极反应式为_________。充电时,Y极的电极反应式为______________。
【答案】 [H:]- Mg2+[:H]- 2Mg2Cu+3H2=MgCu2+3MgH2 MgH2(s)+O2(g)=MgO(s)+H2O(g) △H=-309 kJ·mol-1 T3<T2<T1 ![]() < MgH2+2Li++2e-=Mg+2LiH Li++e-=Li
< MgH2+2Li++2e-=Mg+2LiH Li++e-=Li
【解析】(1)MgH2是一种离子化合物,其电子式为[H:]- Mg2+[:H]-,故答案为:[H:]- Mg2+[:H]-;
(2)Mg2Cu在加压条件下储氢时生成MgH2和MgCu2,反应的化学方程式为2Mg2Cu+3H2= MgCu2+3MgH2,故答案为:2Mg2Cu+3H2=MgCu2+3MgH2;
(3)①根据①MgH2(s)=Mg(s)+H2(g) △H1=+74.4kJ mol-1;
②H2(g)+l/2O2(g)=H2O(g) △H2=-241.8 kJ mol-1;
③Mg(s)+l/2O2(g)=MgO(s) △H3=-141.6 KJ mol-1。
将①+②+③得:MgH2(s)+O2(g)=MgO(s)+H2O(g) △H=(+74.4kJ mol-1)+(-241.8 kJ mol-1)+(-141.6 KJ mol-1)=-309 kJ·mol-1,故答案为:MgH2(s)+O2(g)=MgO(s)+H2O(g) △H=-309 kJ·mol-1;
②温度越高,放出氢气的速率越快,温度由小到大的顺序为T3<T2<T1,故答案为:T3<T2<T1;
(4)①反应2MgO(s)+2SO2(g)+2NO(g)![]() 2MgSO4(s)+N2(g)的平衡常数表达式为K=
2MgSO4(s)+N2(g)的平衡常数表达式为K=![]() ,故答案为:
,故答案为:![]() ;
;
②根据图像,升高温度,平衡常数减小,说明平衡逆向移动,说明正反应为放热反应,a<0,故答案为:<;
(5)根据图像,固态锂为负极,X极为正极,结合放电时的电池反应2Li+MgH2=Mg+2LiH。放电时,X极的电极反应式为MgH2+2Li++2e-=Mg+2LiH。充电时,Y极为阴极,电极反应式为Li++e-=Li,故答案为:MgH2+2Li++2e-=Mg+2LiH;Li++e-=Li。

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案