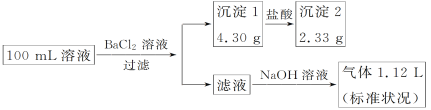
题目内容
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:

(1)则95℃时水的电离平衡曲线应为__(填“A”或“B”).
(2)25℃时,将pH=9的NaOH溶液与pH=3的H2SO4溶液混合,所得溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_____
(3)95℃时,若1体积pH1=a 的某强酸溶液与10体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是:___(用含a、b的等式表示).
(4)95℃时,1L0.05mol/LBa(OH)2溶液中,由水电离出的c(OH-)为______。
【答案】B 100:1 a+b=11 1×10-11mol·L-1
【解析】
(1)常温下,纯水中c(OH-)=c(H+)=10-7mol/L,水的电离是一个吸热过程,温度升高,水的电离程度增大,水电离生成的c(OH-)=c(H+)增大,由此可确定水的电离平衡曲线应为B;答案为B;
(2)25℃时,将pH=9的NaOH溶液与pH=3的H2SO4溶液混合,所得溶液的pH=7,则n(H+))=n(OH-),10-5mol/L×V(NaOH)=10-3mol/L×V(H2SO4),V(NaOH):V(H2SO4)=10-3mol/L:10-5mol/L=100:1;答案为:100:1;
(3)95℃时,若1体积pH1=a的某强酸溶液与10体积pH2=b的某强碱溶液混合后溶液呈中性,仍利用n(H+)=n(OH-)进行计算,则1×10-a=10×10-(12-b),10a+b=1011,a+b=11;答案为:a+b=11;
(4)95℃时,1L0.05mol/LBa(OH)2溶液中,c(OH-)=0.1mol/L,由于由水电离出的c(OH-)等于溶液中的c(H+),即为![]() mol·L-1=1×10-11mol·L-1。答案为:1×10-11mol·L-1。
mol·L-1=1×10-11mol·L-1。答案为:1×10-11mol·L-1。

【题目】氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
(1)根据下列能量变化示意图,请写出![]() 和CO反应的热化学方程式______。
和CO反应的热化学方程式______。

(2)在固定体积的密闭容器中,进行如下化学反应: ![]()
![]() H<0,其平衡常数K与温度T的关系如下表:
H<0,其平衡常数K与温度T的关系如下表:
T/K | 298 | 398 | 498 |
平衡常数K |
|
|
|
①试判断![]() ______
______![]() (填写>、=,<)
(填写>、=,<)
②下列各项能说明该反应已达到平衡状态的是_______(填字母)
a. 容器内![]() 、
、![]() 、
、![]() 的浓度之比为1:3:2
的浓度之比为1:3:2
b. ![]()
c. 容器内压强保持不变
d. 混合气体的密度保持不变
(3)对反应![]()
![]() H>0,在温度分别为
H>0,在温度分别为![]() 、
、![]() 时,平衡体系中
时,平衡体系中![]() 的体积分数随压强变化曲线如下图所示。
的体积分数随压强变化曲线如下图所示。

①A、C两点的反应速率:A_________C(填>、=、<)
②A、C两点![]() 的转化率:A_________C(填>、=、<)
的转化率:A_________C(填>、=、<)
③由状态B到状态A,可以采用的方法是__________。
(4)一定温度下
①若在1L的密闭容器中,充入1 mol![]() 和3 mol
和3 mol![]() 发生反应,并维持容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则
发生反应,并维持容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则![]() 的转化率a(
的转化率a(![]() )=______,以
)=______,以![]() 表示该过程的反应速率v(
表示该过程的反应速率v(![]() )=_________.
)=_________.
②若在1L的密闭容器中,充入2mol![]() 和6mol
和6mol![]() 发生反应,并维持压强恒定,达到平衡时,
发生反应,并维持压强恒定,达到平衡时, ![]() 平衡浓度比①中
平衡浓度比①中![]() 平衡浓度的2倍________。(填>、=、<)
平衡浓度的2倍________。(填>、=、<)
【题目】下列实验的现象、解释或结论正确的是( )
选项 | 实验 | 解释或结论 |
A | 向某溶液中逐渐通入CO2气体,先出现白色胶状沉淀,继续通入CO2气体,白色胶状沉淀不溶解,证明该溶液中存在AlO2- | Al(OH)3是两性氢氧化物,不溶于碳酸溶液 |
B | 在新制氯水中加入碳酸钙粉末,充分搅拌,氯水的漂白性增强 | 氯水中HClO的物质的量浓度增大 |
C | 用蒸馏法能将溶解在CCl4中的碘分离出来 | 因为碘易升华,先分离出来 |
D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,则溶液变为黄色 | 氧化性:H2O2 > Fe3+ |
A.AB.BC.CD.D