题目内容
【题目】用O2将HCl转化为Cl2,可提高效益,减少污染,
(1)传统上该转化通过如图所示的催化剂循环实现,

其中,反应①为:2HCl(g)+CuO(s)![]() H2O(g)+CuCl2(g) △H1
H2O(g)+CuCl2(g) △H1
反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为 , (反应热用△H1和△H2表示)。
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性,
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的aHCl—T曲线如图12,则总反应的△H 0,(填“>”、“﹦”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是 。

②在上述实验中若压缩体积使压强增大,画出相应aHCl—T曲线的示意图,并简要说明理由: 。
③下列措施中有利于提高aHCl的有 。
A、增大n(HCl) B、增大n(O2) C、使用更好的催化剂 D、移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
n(Cl2)/10-3mol | 0 | 1.8 | 3.7] | 5.4 | 7.2 |
计算2.0~6.0min内以HCl的物质的量变化表示的反应速率(以mol·min-1为单位)。
【答案】
(1)2HCl(g)+1/2O2(g)![]() H2O(g)+Cl2(g)△H=△H1+△H2
H2O(g)+Cl2(g)△H=△H1+△H2
(2)①<;K(A);②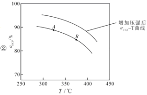 ;增大压强,平衡右移,ɑHCl增大,相同温度下,HCl的平衡转化率比之前实验的大;③BD
;增大压强,平衡右移,ɑHCl增大,相同温度下,HCl的平衡转化率比之前实验的大;③BD
(3)1.8×10-3mol/min
【解析】
试题分析:(1)根据图象信息,箭头指向的是生成物可写出反应②的热化学方程式:CuCl2(g)+![]() O2(g)
O2(g) ![]() CuO(s)+Cl2(g)△H2,则①+②可得总反应2HCl(g)+
CuO(s)+Cl2(g)△H2,则①+②可得总反应2HCl(g)+![]() O2(g)
O2(g) ![]() H2O(g)+Cl2(g),△H=△H1+△H2,故答案为:2HCl(g)+
H2O(g)+Cl2(g),△H=△H1+△H2,故答案为:2HCl(g)+![]() O2(g)
O2(g) ![]() H2O(g)+Cl2(g),△H=(△H1+△H2)kJ/mol;
H2O(g)+Cl2(g),△H=(△H1+△H2)kJ/mol;
(2)①根据图1、2可知随着温度的升高,aHCl减小,说明升高温度,平衡向逆向移动,则可知逆反应吸热反应,所以正反应是放热反应,故△H<0,同时由于升高温度,平衡逆移,则生成物减少,温度是B点大于A点,所以平衡常数K(A)>K(B);故答案为:<;K(A);
②同时由于该总反应是气体系数减小的反应,所以,压缩体积使压强增大,一定温度下,平衡应正向移动,ɑHCl应较题目实验状态下为大,所以可得曲线图: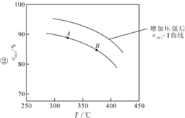 ;故答案为:
;故答案为: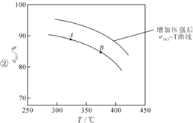 增大压强,平衡右移,ɑHCl增大,相同温度下,HCl的平衡转化率比之前实验的大;
增大压强,平衡右移,ɑHCl增大,相同温度下,HCl的平衡转化率比之前实验的大;
③A、增大n(HCl),平衡正向移动,但是平衡移动使HCl减少的趋势小于增加HCl使增大的趋势,所以HCl的转化率减小,故A错误;B、增大n(O2),反应物的浓度增大,平衡向正向移动,HCl转化率增大,故B正确;C、使用更好的催化剂,不能使化学平衡发生移动,实验HCl的转化率不变,故C错误;D、移去H2O,及减小了生成物的浓度,平衡向正反应方向移动,HCl转化率增大,故D正确;故答案为:BD;
(3)题目中给出的是n(Cl2)的数据,要求的是以HCl的物质的量变化表示的反应速率,所以根据方程式进行计算,注意是2.0~6.0min内的速率,单位是molmin-1:设2.0~6.0min内,HCl转化的物质的量为n,则:
2HCl(g)+![]() O2(g)=H2O(g)+Cl2(g)
O2(g)=H2O(g)+Cl2(g)
2 1
n (5.4-1.8)×10-3mol
解得 n=7.2×10-3mol,
![]() ═1.8×10-3mol/min,故答案为:1.8×10-3mol/min;
═1.8×10-3mol/min,故答案为:1.8×10-3mol/min;
