题目内容
酸根离子XO32-所含电子数比碳酸根离子CO32-的电子数多10,则下列说法不正确的是( )
A.XO32-中X元素与CO32-中C元素的化合价相同
B.XO32-与CO32-都只能被还原,不能被氧化
C.X和C不是同周期元素,但都属于主族元素
D.XO32-与CO32-都能在溶液中与XO2反应
【答案】
B
【解析】
试题分析:酸根离子XO32-所含电子数比碳酸根离子CO32-的电子数多10,则X的原子序数是16,即X是S元素。A正确,化合价都是+4价;+4价的S既可以被氧化,也可以被还原,B不正确;C正确,二者分别是第ⅣA和第ⅥA族元素;D正确,SO2和XO32-与CO32-都反应,分别生成HSO3-和CO2,答案选B。
考点:考查元素化合价、氧化性于还原性、元素在周期表中的位置以及性质的有关判断
点评:该题是中等难度的试题,试题基础性强,在注重对学生基础知识巩固和检验的同时,侧重对学生能力的培养和方法的指导于训练。旨在培养学生灵活运用基础知识解决实际问题的能力。

练习册系列答案
相关题目
酸根离子XO32-所含电子数比碳酸根离子CO32-的电子数多10,则下列说法不正确的是( )
| A.XO32-中X元素与CO32-中C元素的化合价相同 |
| B.XO32-与CO32-都只能被还原,不能被氧化 |
| C.X和C不是同周期元素,但都属于主族元素 |
| D.XO32-与CO32-都能在溶液中与XO2反应 |
X、Y、Z为周期表中常见元素,原子序数递增,X、Y原子的最外层电子数是其电子层数的2倍,Z单质是生产生活中用量最大的金属.
(1)X、Y的原子可构成一种物质,该物质与某能引起温室效应的气体结构相同;该物质的电子式是______.
(2)下列含氧酸根离子的化学式书写不正确的是______(填序号).
a.XO3- b.XO32- c.YO32- d.Y2O32- e.YO3- f.YO42-
(3)Z单质与其它化合物可满足如图所示转化关系:
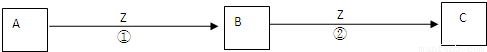
①C溶液在储存时应加入少量Z,其理由是(用文字和离子方程式回答)______.
②将5~6滴B的饱和溶液滴入沸水中,可得到红褐色液体,该液体能产生丁达尔效应.该反应的离子方程式为______.
(4)Y的最高价含氧酸是重要的化工产品.
①已知YO2被空气氧化,每生成1mol气态YO3,放出98.3kJ热量.该反应的热化学方程式是______.
②实验测得相同条件下一定量的Y单质分别在空气和在氧气中充分燃烧后产物的成分(体积分数)如下表.
Y在纯氧中燃烧的产物中YO3含量比在空气中燃烧YO3含量少,试分析其原因______.
(1)X、Y的原子可构成一种物质,该物质与某能引起温室效应的气体结构相同;该物质的电子式是______.
(2)下列含氧酸根离子的化学式书写不正确的是______(填序号).
a.XO3- b.XO32- c.YO32- d.Y2O32- e.YO3- f.YO42-
(3)Z单质与其它化合物可满足如图所示转化关系:

①C溶液在储存时应加入少量Z,其理由是(用文字和离子方程式回答)______.
②将5~6滴B的饱和溶液滴入沸水中,可得到红褐色液体,该液体能产生丁达尔效应.该反应的离子方程式为______.
(4)Y的最高价含氧酸是重要的化工产品.
①已知YO2被空气氧化,每生成1mol气态YO3,放出98.3kJ热量.该反应的热化学方程式是______.
②实验测得相同条件下一定量的Y单质分别在空气和在氧气中充分燃烧后产物的成分(体积分数)如下表.
| YO2 | YO3 | |
| 空气 | 94%-95% | 5%-6% |
| 氧气 | 97%-98% | 2%-3% |

