题目内容
【题目】(1)纳米级Cu2O具有优良的催化性能,制取Cu2O的方法有:加热条件下用液态肼(N2H4)还原新制Cu(OH)2制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 _。
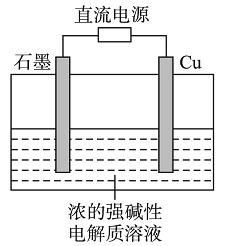
(2)用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2O![]() Cu2O+H2↑,如图1 所示。该电解池的阳极反应式为 。
Cu2O+H2↑,如图1 所示。该电解池的阳极反应式为 。

(3)钒液流电池(如图2所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过。电池放电时负极的电极反应式为 ,电池充电时阳极的电极反应式是 。
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定某溶液中的含钒量,反应的离子方程式为:2VO![]() +H2C2O4+2H+===2VO2++2CO2↑+2H2O,取25.00 mL 0.1000 mol/L H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0 mL,由此可知,该(VO2)2SO4溶液中钒的含量为 g/L(保留一位小数)。
+H2C2O4+2H+===2VO2++2CO2↑+2H2O,取25.00 mL 0.1000 mol/L H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0 mL,由此可知,该(VO2)2SO4溶液中钒的含量为 g/L(保留一位小数)。
【答案】(1)4Cu(OH)2+N2H4![]() 2Cu2O+N2↑+6H2O
2Cu2O+N2↑+6H2O
(2)2Cu-2e-+2OH-===Cu2O+H2O
(3)V2+-e-===V3+;VO2+-e-+H2O===VO![]() +2H+
+2H+
(4)10.6
【解析】
试题分析:(1)根据给出的反应物和生成物,可直接写出该反应的化学方程式为:4Cu(OH)2+N2H4![]() 2Cu2O+N2↑+6H2O 。
2Cu2O+N2↑+6H2O 。
(2)阳极发生氧化反应,元素的化合价升高,从反应方程式中看出Cu 元素的化合价升高,故阳极是Cu 放电生成Cu2O ,电极反应为:2Cu-2e-+2OH-===Cu2O+H2O。
(3)电池放电时,负极发生氧化反应,元素的化合价升高,所以V2+失去电子生成V3+,电极反应式是V2+-e-===V3+;电池充电时阳极发生氧化反应,则元素的化合价升高,根据装置图,所以正极中的VO2+失去电子,结合水生成VO![]() 和H+,电极反应式是VO2+-e-+H2O===VO
和H+,电极反应式是VO2+-e-+H2O===VO![]() +2H+。
+2H+。
(4)根据草酸的物质的量25×10-3L×0.1 mol/L,可知VO![]() 的物质的量是2×25×10-3 L×0.1 mol/L=5×10-3 mol,则该(VO2)2SO4溶液中钒的含量为5×10-3 mol×51g/mol/(24×10-3 L)=10.625g/L。
的物质的量是2×25×10-3 L×0.1 mol/L=5×10-3 mol,则该(VO2)2SO4溶液中钒的含量为5×10-3 mol×51g/mol/(24×10-3 L)=10.625g/L。

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案