题目内容
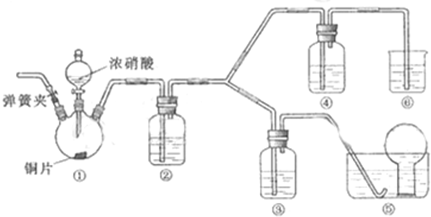
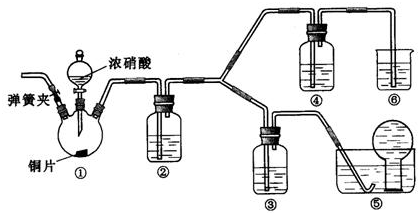
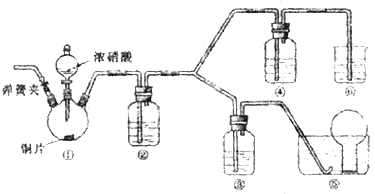
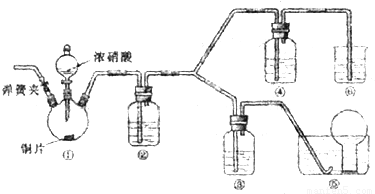
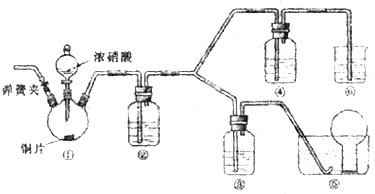
某小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去).实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO,由此得出的结论是浓硝酸的氧化性强于稀硝酸.
可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应,方程式:为2NO2+2NaOH=NaNO3+NaNO2+H2O.
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是
(2)组装仪器,检验气密性,通二氧化碳气体一段时间,关闭止水夹,将导管口伸进水槽中烧瓶里.通二氧化碳的目的是
(3)装置①中发生反应的化学方程式是
(4)装置②中发生反应的化学方程式是
(5)该小组得出结论所依据的实验现象是

可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应,方程式:为2NO2+2NaOH=NaNO3+NaNO2+H2O.
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是
3mol/L稀硝酸、浓硝酸、氢氧化钠溶液
3mol/L稀硝酸、浓硝酸、氢氧化钠溶液
.(2)组装仪器,检验气密性,通二氧化碳气体一段时间,关闭止水夹,将导管口伸进水槽中烧瓶里.通二氧化碳的目的是
排除装置中的氧气
排除装置中的氧气
.(3)装置①中发生反应的化学方程式是
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
.(4)装置②中发生反应的化学方程式是
3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
.(5)该小组得出结论所依据的实验现象是
④中液面上方气体变为红棕色,③中液面上方气体不变色
④中液面上方气体变为红棕色,③中液面上方气体不变色
.分析:(1)结合实验目的,根据装置特点分析各装置的作用,再根据物质的性质的判断;
(2)装置中残存的空气能氧化NO而对实验产生干扰;
(3)Cu与浓HNO3反应生成Cu(NO3)2、NO2、H2O;
(4)根据实验目的及装置图可知,装置②产生NO;
(5)根据对比实验与性质判断装置③、④的实验现象.
(2)装置中残存的空气能氧化NO而对实验产生干扰;
(3)Cu与浓HNO3反应生成Cu(NO3)2、NO2、H2O;
(4)根据实验目的及装置图可知,装置②产生NO;
(5)根据对比实验与性质判断装置③、④的实验现象.
解答:解:(1)根据装置特点和实验目的,装置⑤是收集NO,装置⑥中盛放NaOH溶液吸收NO2,因为要验证稀HNO3不能氧化NO,所以装置③中应该盛放稀硝酸,④盛放浓硝酸,生成二氧化氮气体,应用氢氧化钠溶液吸收,
故答案为:3mol/L稀硝酸、浓硝酸、氢氧化钠溶液;
(2)由于装置中残存的空气能氧化NO而对实验产生干扰,所以滴加浓HNO3之前需要通入一段时间CO2赶走装置中的空气,同时也需将装置⑤中导管末端伸入倒置的烧瓶内防止反应产生的NO气体逸出,故答案为:排除装置中的氧气;
(3)Cu与浓HNO3反应生成Cu(NO3)2、NO2、H2O,所以反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
(4)装置②中盛放H2O,使NO2与H2O反应生成NO:3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;
(5)NO通过稀HNO3溶液后,若无红棕色NO2产生,说明稀HNO3不能氧化NO,所以盛放稀HNO3装置的液面上方没有颜色变化即可说明之.装置④中盛放的是浓HNO3,若浓HNO3能氧化NO则装置④液面的上方会产生红棕色气体,
故答案为:④中液面上方气体变为红棕色,③中液面上方气体不变色.
故答案为:3mol/L稀硝酸、浓硝酸、氢氧化钠溶液;
(2)由于装置中残存的空气能氧化NO而对实验产生干扰,所以滴加浓HNO3之前需要通入一段时间CO2赶走装置中的空气,同时也需将装置⑤中导管末端伸入倒置的烧瓶内防止反应产生的NO气体逸出,故答案为:排除装置中的氧气;
(3)Cu与浓HNO3反应生成Cu(NO3)2、NO2、H2O,所以反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
(4)装置②中盛放H2O,使NO2与H2O反应生成NO:3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;
(5)NO通过稀HNO3溶液后,若无红棕色NO2产生,说明稀HNO3不能氧化NO,所以盛放稀HNO3装置的液面上方没有颜色变化即可说明之.装置④中盛放的是浓HNO3,若浓HNO3能氧化NO则装置④液面的上方会产生红棕色气体,
故答案为:④中液面上方气体变为红棕色,③中液面上方气体不变色.
点评:本题考查浓、稀硝酸氧化性强弱探究实验的有关判断,是高考中的常见题型,试题综合性强,浓度较大.本题以“探究稀、浓HNO3氧化性相对强弱”为载体,考查稀、浓HNO3性质,重点应结合实验目的,实验所给装置图及药品,信息,加工提炼出实验设计的原理,这是解探究性实验的灵魂所在.有利于培养学生、化学基本实验设计和评价能力.该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目