题目内容
(2011?福建模拟)已知25℃时有关弱酸的电离平衡常数:则下列有关说法正确的是( )
|
分析:A、利用酸的电离常数比较酸性的强弱,再利用盐中酸根离子对应的酸越弱,其水解程度越大来分析.
B、等体积混合,若a=b恰好完全反应,因CN-的水解溶液中c(Na+)>c(CN-).
C、冰醋酸中逐滴加水电离程度一直在增大,pH也是增大且无限接近中性溶液的pH.
D、利用电荷守恒来分析.
B、等体积混合,若a=b恰好完全反应,因CN-的水解溶液中c(Na+)>c(CN-).
C、冰醋酸中逐滴加水电离程度一直在增大,pH也是增大且无限接近中性溶液的pH.
D、利用电荷守恒来分析.
解答:解:A、由电离常数Ka的关系可知,1.8×10-5>4.9×10-10>5.6×10-11,则酸性CH3COOH>HCN>HCO3-,显然等浓度时Na2CO3的水解程度最大,其溶液的pH最大,则等物质的量浓度的各溶液pH关系为pH(Na2CO3)>pH(NaCN)>pH(CH3COONa),故A错误.
B、等体积混合,若a=b恰好完全反应,因CN-的水解溶液中存在c(Na+)>c(CN-),a<b时溶液中存在c(Na+)>c(CN-),即所得溶液中c(Na+)>c(CN-)时a≤b,故B错误;
C、冰醋酸中逐滴加水,电离产生的离子浓度增大,导电性增大,但随水的量增大,浓度变小,导电性减小,而在加水的过程中电离程度、pH一直在增大,故C错误;
D、因溶液不显电性,则所有阳离子带的电荷总数等于阴离子带的负电荷总数,即c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故D正确;
故选D.
B、等体积混合,若a=b恰好完全反应,因CN-的水解溶液中存在c(Na+)>c(CN-),a<b时溶液中存在c(Na+)>c(CN-),即所得溶液中c(Na+)>c(CN-)时a≤b,故B错误;
C、冰醋酸中逐滴加水,电离产生的离子浓度增大,导电性增大,但随水的量增大,浓度变小,导电性减小,而在加水的过程中电离程度、pH一直在增大,故C错误;
D、因溶液不显电性,则所有阳离子带的电荷总数等于阴离子带的负电荷总数,即c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故D正确;
故选D.
点评:本题考查盐类水解、弱电解质的电离及溶液中离子浓度的关系,明确溶液中的溶质及酸性强弱的比较、电荷守恒是解答本题的关键,A是学生解答的易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 (2011?福建模拟)美国普度大学的研究人员开发出一种利用铝镓合金制备氢气的新工艺(如图所示). 下列有关该工艺的说法错误的是( )
(2011?福建模拟)美国普度大学的研究人员开发出一种利用铝镓合金制备氢气的新工艺(如图所示). 下列有关该工艺的说法错误的是( )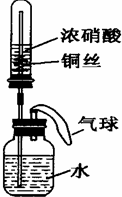 (2011?福建模拟)某同学利用如图所示装置进行实验,一段时间后,水沿导管缓慢上升,下列说法错误的是( )
(2011?福建模拟)某同学利用如图所示装置进行实验,一段时间后,水沿导管缓慢上升,下列说法错误的是( )