题目内容
【题目】已知A、B、C、D、E、F都是周期表中前四周期元素,它们的核电荷数A。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满。请根据以上信息,回答下列问题: (答题时用所对应的元素符号表示)
(1)A、B、C、D的第一电离能由小到大的顺序为________________________。
(2)将以下三种物质①B的氯化物②D的氯化物③A、C形成的一种具有高硬度、耐磨新型无机非金属材料,按熔点由高到低的顺序排列__________________(用序号排列表示)。
(3)A的最高价氧化物对应的水化物分子中,其中心原子采取_____杂化,E的最高价氧化物分子的空间构型是___________________。
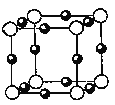
(4)F的基态原子的核外电子排布式是_______________,A、F形成某种化合物的晶胞结构如下图所示,则其化学式为____________,A、F配位数依次为______、________。(黑球为F,白球为A)
【答案】 Na<Al<Si<N ③①② sp2 平面正三角形 ls22s22p63s23p63d104s1 (或[Ar]3d104s1) Cu3N 6 2
【解析】A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。C元素是地壳中含量最高的金属元素,则C为Al元素;A原子核外有三个未成对电子,原子序数小于Al元素,其电子排布式为1s22s22p3,则A为N元素;E原子核外的M层中只有两对成对电子,电子排布式为1s22s22p63s23p4,则E为S元素;D单质的晶体类型在同周期的单质中没有相同的,D处于第三周期,故D为Si元素;化合物B2E的晶体为离子晶体,B应为第ⅠA族元素,且原子序数在N元素和Al之间,则B为Na元素;F原子核外最外层电子数与B相同,其余各层均充满,且原子序数最大,电子排布式为ls22s22p63s23p63d104s1,故F为Cu元素。
(1)在元素周期表中,同一周期元素的第一电离能从左到右呈增大趋势,同一主族元素的第一电离能从上到下逐渐减小,据此可判断四种元素的第一电离能的顺序为:Na<Al<Si<N,故答案:Na<Al<Si<N;
(2)①B的氯化物为氯化钠,为离子晶体,②D的氯化物为SiCl4,为分子晶体③A、C形成的物质具有高硬度、耐磨特性,属于原子晶体,则熔点由高到低的顺序为③①②,故答案为:③①②;
(3)A的最高价酸根离子NO3-,中心N原子价层电子对数为3+![]() =3,则N原子采取sp2杂化;E的最高价氧化物为SO3,S原子孤电子对数为
=3,则N原子采取sp2杂化;E的最高价氧化物为SO3,S原子孤电子对数为![]() =0,价层电子对数为3+0=3,则为平面三角形结构,故答案为:sp2;平面三角形;
=0,价层电子对数为3+0=3,则为平面三角形结构,故答案为:sp2;平面三角形;
(4)F为Cu元素,其核外电子排布式为:1s22s22p63s23p63d104s1(或[Ar]3d104s1),F为Cu,A为N,且N为-3价,由晶胞结构图可知,N原子在顶点,则N原子数为8×![]() =1,Cu原子在棱心,则Cu原子数为12×
=1,Cu原子在棱心,则Cu原子数为12×![]() =3,所以化学式为Cu3N;根据图示,Cu原子位于棱上,N原子在顶点,每个Cu原子周围有2个N原子,每个N原子周围有6个铜原子,N、Cu的配位数依次为6、2,故答案为:ls22s22p63s23p63d104s1 (或[Ar]3d104s1);Cu3N;6;2。
=3,所以化学式为Cu3N;根据图示,Cu原子位于棱上,N原子在顶点,每个Cu原子周围有2个N原子,每个N原子周围有6个铜原子,N、Cu的配位数依次为6、2,故答案为:ls22s22p63s23p63d104s1 (或[Ar]3d104s1);Cu3N;6;2。

 阅读快车系列答案
阅读快车系列答案