题目内容
乙醇在一定条件下与溴化钠和浓硫酸反应可制取溴乙烷。已知反应物用量:NaBr固体0.24 mol,C2H5OH 0.2 mol(密度为0.7893 g·cm-3),98% H2SO4 35 mL(密度1.84 g·cm-3),H2O 25 mL,实验产率约为60%—65%。(1)请完成制取溴乙烷的化学方程式:______________________________。
若按烧瓶内液体的体积不小于烧瓶容积的1/3,不大于烧瓶容积的2/3,则反应装置中烧瓶的容积最合适的是_________。
A.50 mL B.100 mL C.150 mL D.250 mL
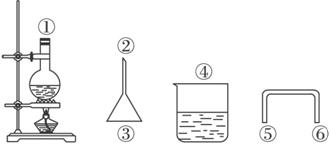
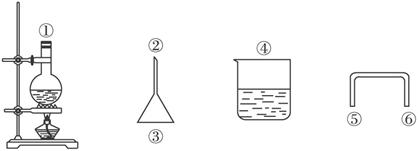
(2)用下图仪器安装反应装置,要求达到减少反应物损失、防止环境污染的目的,有关仪器连接顺序为_________ (填数字)。
(3)反应过程中,可能发生的副反应为(至少填两个):
_____________________________________________________________________,_____________________________________________________________________。
(4)实验结果从反应混合物中分离出粗制黄色的溴乙烷,产生黄色的主要原因是其含有____________(填化学式)。欲得到无色的溴乙烷的方法是_______________(填试剂和操作名称)。
(5)本实验的理论产量为____________g。
(1)NaBr+H2SO4====NaHSO4+HBr,C2H5OH+HBr![]() C2H5Br+H2O
C2H5Br+H2O
或:NaBr+H2SO4+C2H5OH![]() NaHSO4+C2H5Br+H2O C
NaHSO4+C2H5Br+H2O C
(2)①⑤⑥②③④或①⑥⑤②③④
(3)CH3CH2OH![]() C2H4↑+H2O(或者生成乙醚也可) 2HBr+H2SO4====Br2+SO2↑+2H2O
C2H4↑+H2O(或者生成乙醚也可) 2HBr+H2SO4====Br2+SO2↑+2H2O
(4)Br2,稀碱溶液或Na2SO3溶液 分液
(5)21.8
解析:此题为实验制备,做此题的一般方法为:明确实验目的,理解反应的原理和计算原理。在弄清原理后,结合所给仪器,再进行仪器的连接,然后再具体考虑实验的每一步。
C2H5 — C2H5Br
0.2 mol 0.2 mol
m(C2H5Br)=m·M=0.2 mol×109 g·mol-1=21.8 g

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案