题目内容
已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-Q1kJ/mol
2H2(g)+O2(g)═2H2O(g)△H=-Q2kJ/mol
2H2(g)+O2(g)═2H2O(l)△H=-Q3kJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则放出的热量为( )kJ.
2H2(g)+O2(g)═2H2O(g)△H=-Q2kJ/mol
2H2(g)+O2(g)═2H2O(l)△H=-Q3kJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则放出的热量为( )kJ.
| A.0.4Q1+0.05Q3 | B.0.4Q1+0.05Q2 |
| C.0.4Q1+0.1Q3 | D.0.4Q1+0.1Q2 |
甲烷和氢气的混合气体11.2L(已折合成标准状况),
所以甲烷和氢气的混合气体的总的物质的量为
=0.5mol,
甲烷和氢气的体积比为4:1,所以甲烷的物质的量为0.5mol×
=0.4mol,氢气的物质的量为0.5mol-0.4mol=0.1mol.
由CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-Q1kJ/mol可知,
0.4mol甲烷燃烧放出的热量为0.4mol×Q1kJ/mol=0.4Q1kJ;
由2H2(g)+O2(g)═2H2O(l);△H=-Q3kJ/mol可知,
0.1mol氢气燃烧生成液态水放出的热量为0.1mol×
×Q3kJ/mol=0.05Q3kJ.
所以放出的热量为0.4Q1+0.05Q3.
故选A.
所以甲烷和氢气的混合气体的总的物质的量为
| 11.2L |
| 22.4L/mol |
甲烷和氢气的体积比为4:1,所以甲烷的物质的量为0.5mol×
| 4 |
| 5 |
由CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-Q1kJ/mol可知,
0.4mol甲烷燃烧放出的热量为0.4mol×Q1kJ/mol=0.4Q1kJ;
由2H2(g)+O2(g)═2H2O(l);△H=-Q3kJ/mol可知,
0.1mol氢气燃烧生成液态水放出的热量为0.1mol×
| 1 |
| 2 |
所以放出的热量为0.4Q1+0.05Q3.
故选A.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
 CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如右图所示,下列说法正确的是
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如右图所示,下列说法正确的是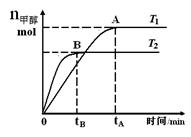
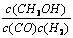
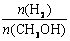 增大
增大