题目内容
一定量的质量分数为14%的KOH溶液,若将其蒸发掉100g水后,其质量分数为28%,体积为80mL,则浓缩后的KOH的物质的量浓度为( )A.2.2mol?L-1
B.4mol?L-1
C.5mol?L-1
D.6.25mol?L-1
【答案】分析:根据蒸发前后溶质的质量不变,计算出原溶液的质量,根据质量分数计算溶质的物质的量,进而计算溶液的物质的量浓度.
解答:解:设14%氢氧化钾溶液的质量为m,蒸发前后溶质的质量不变,则有m×14%=(m-100g)×28%,解得m=200g,
28%的氢氧化钾溶液中含有氢氧化钾的物质的量为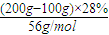 =0.5mol,
=0.5mol,
所得溶液的物质的量浓度为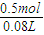 =6.25mol/L,
=6.25mol/L,
故选:D.
点评:考查物质的量浓度的计算,难度不大,本题注意计算蒸发后溶液的质量为解答该题的关键.
解答:解:设14%氢氧化钾溶液的质量为m,蒸发前后溶质的质量不变,则有m×14%=(m-100g)×28%,解得m=200g,
28%的氢氧化钾溶液中含有氢氧化钾的物质的量为
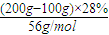 =0.5mol,
=0.5mol,所得溶液的物质的量浓度为
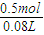 =6.25mol/L,
=6.25mol/L,故选:D.
点评:考查物质的量浓度的计算,难度不大,本题注意计算蒸发后溶液的质量为解答该题的关键.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目