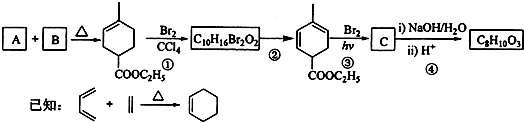
题目内容
【题目】为探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图1所示的实验装置(支撑用的铁架台省略),按要求回答问题 
(1)在实验中,A部分的装置是(填图2中字母序号),写出A中发生的离子化学方程式 .
(2)①装置B中盛放的试剂名称为 , 作用是 ②装置D和E中出现的不同现象说明了
③装置F的作用是
④写出装置G中发生反应的离子方程式
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置.你认为该装置应加在与之间(填装置字母序号),装置中应放入试剂(填写试剂或用品名称).
【答案】
(1)b;MnO2+4H++2Cl﹣ ![]() ?Mn2++Cl2↑+2H2O
?Mn2++Cl2↑+2H2O
(2)无水硫酸铜;证明有水蒸气产生;氯气无漂白性,次氯酸有漂白性;吸收氯气;Ag++Cl﹣=AgCl↓
(3)F;G;湿润的淀粉KI试纸(或湿润的有色布条)
【解析】解:(1)根据实验的目的,需制取氯气,在实验中,A部分为制取氯气装置,实验室用二氧化锰与浓盐酸加热制备氯气,为固体和液体需加热制取气体的装置,应选择装置b ,二氧化锰与浓盐酸反应生成氯化锰、氯气和水,化学方程式:MnO2+4HCl ![]() MnCl2+Cl2↑+2H2O,离子方程式为:MnO2+4H++2Cl﹣
MnCl2+Cl2↑+2H2O,离子方程式为:MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O,
Mn2++Cl2↑+2H2O,
所以答案是:b;MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O;(2)①装置A制取氯气,制备Cl2的过程中有水蒸气挥发出来,为了证明水蒸气的存在,需无水硫酸铜与水反应生成蓝色五水合硫酸铜晶体来检验水,
Mn2++Cl2↑+2H2O;(2)①装置A制取氯气,制备Cl2的过程中有水蒸气挥发出来,为了证明水蒸气的存在,需无水硫酸铜与水反应生成蓝色五水合硫酸铜晶体来检验水,
所以答案是:无水硫酸铜;证明有水蒸气产生;②干燥的氯气没有漂白性,D中有色布条不褪色,氯气与水反应生成的HClO具有漂白性,E中湿润的有色布条褪色,说明氯气没有漂白性,氯水有漂白性,
所以答案是:氯气无漂白性,次氯酸有漂白性;③氯气通入硝酸银溶液也会生成AgCl沉淀,装置F的作用:除去氯气,防止对HCl气体检验的干扰,
所以答案是:吸收氯气;④装置G中银离子和氯离子反应生成氯化银,离子方程式为:Ag++Cl﹣=AgCl↓,
所以答案是:Ag++Cl﹣=AgCl↓;(3)G装置用来检验HCl气体,为了确保实验结论的可靠性,应排除氯气的干扰,在F吸收氯气之后要检验氯气是否完全除去,根据氯气具有强氧化性的性质,可用湿润的淀粉KI试纸检验(或湿润的有色布条),如不变色,说明已经完全除去,
所以答案是:F、G;湿润的淀粉KI试纸(或湿润的有色布条).

 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案