题目内容
【题目】在4L密闭容器中充入6molA气体和5molB气体,在一定条件下发生反应:3A(g)+B(g) ![]() 2C(g)+xD(g),达到平衡时,生成了2molC,经测定D的浓度为0.5molL﹣1 , 下列判断正确的是( )
2C(g)+xD(g),达到平衡时,生成了2molC,经测定D的浓度为0.5molL﹣1 , 下列判断正确的是( )
A.x=1
B.B的转化率为20%
C.平衡时A的浓度为1.50molL﹣1
D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
【答案】B
【解析】解:达到平衡时,生成了2molC,D的物质的量为4L×0.5mol/L=2mol, 3A(g)+B(g)2C(g)+xD(g)
起始:6mol 5mol0 0
转化:3mol 1mol2mol xmol
平衡:3mol 4mol2mol 2mol
A.由以上分析可知x=2,故A错误;
B.的转化率为 ![]() =20%,故B正确;
=20%,故B正确;
C.平衡时A的浓度为 ![]() =0.75mol/L,故C错误;
=0.75mol/L,故C错误;
D.反应前后气体的物质的量不变,则压强不变,故D错误.
故选B.
【考点精析】解答此题的关键在于理解化学平衡的计算的相关知识,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】如图,利用培养皿探究SO2的性质,实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面扣在上面。表中对实验现象的描述或解释不正确的是
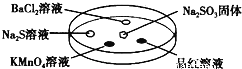
选项 | 实验现象 | 解释 |
A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
D | 品红溶液褪色 | SO2具有漂白性 |
A. A B. B C. C D. D