题目内容
【题目】下列有关物质的性质与用途具有对应关系的是( )
A.SO2具有氧化性,可用于漂白纸浆
B.NH4HCO3受热易分解,可用作氮肥
C.Fe2(SO4)3易溶于水,可用作净水剂
D.Al2O3熔点高,可用作耐高温材料
【答案】D
【解析】解:A.二氧化硫化合价居于中间价态,具有氧化性和还原性,但漂白纸张是利用二氧化硫的漂白性,不是其氧化性,故A错误;
B.做氮肥是利用碳酸氢铵溶解后的铵根离子被植物吸收做氮肥,不是利用其分解的性质,故B错误;
C.硫酸铁溶液中铁离子水解生成氢氧化铁胶体具有吸附悬浮杂质的作用,可以净水,不是利用的易溶于水的性质,故C错误;
D.Al2O3熔点高,不易熔融可用作耐高温材料,故D正确;
故选D.

【题目】(1)某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量(用n(H2)表示)对N2(g)+3H2(g) ![]() 2NH3(g) ΔH < 0反应的影响,实验结果可表示成如下图所示的规律(图中T表示温度,n表示物质的量):
2NH3(g) ΔH < 0反应的影响,实验结果可表示成如下图所示的规律(图中T表示温度,n表示物质的量):
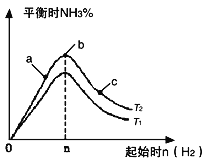
① 比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是_____________;
② 若容器容积为1L,n=3mol,反应达到平衡时H2的转化率为60%,H2与 N2物质的量之比为3∶1,则在起始时体系中加入N2的物质的量为___________mol,此条件下(T2),反应的平衡常数K = ______________;
③ 图像中T2和T1的关系是T2_____________ T1(填“高于”、“低于”、“等于”、“无法确定”)。
(2)N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2 N2O5 (g)4NO2(g)+O2(g)△H>0T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/molL-1 | 5.00 | 3.52 | 2.50 | 2.50 |
①达平衡后其他条件不变,将容器的体积压缩到原来的![]() ,则c(N2O5)_______(填“大于”、“小于”、“等于”、“无法确定”)5.00molL-1
,则c(N2O5)_______(填“大于”、“小于”、“等于”、“无法确定”)5.00molL-1
②500s内N2O5分解速率为 ____________;
③T1温度下 平衡时N2O5的转化率为____________;
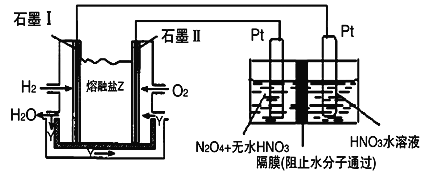
(3)现以H2、O2与熔融盐Na2CO3组成的燃料电池(如图所示,其中Y为CO2)装置进行电解。
写出石墨II电极上发生反应的电极反应式__________________ 。
在电解池中生成N2O5的电极反应式为__________________ 。
【题目】描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱电解质的电离平衡常数:
酸或碱 | 电离常数(Ka或Kb) | 难(微)溶物 | 溶度积常数(Ksp) |
CH3COOH | 1.8×10-5 | BaSO4 | 1×10-10 |
HNO2 | 4.6×10-4 | BaCO3 | 2.6×10-9 |
HCN | 5×10-10 | CaSO4 | 7×10-5 |
HClO | 3×10-8 | CaCO3 | 5×10-9 |
NH3·H2O | 1.8×10-5 |
请回答下面问题:
(1)上述四种酸中,酸性最弱的是_____________ (用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是________________(填序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈________ (选填“酸性”“中性”或“碱性”),理由是__________________,溶液中各离子浓度大小的关系是_____________________。
(3)物质的量1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大到小排列为_____________________________________。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度达到0.0lmol·L-1以上,则溶液中CO32-物质的量浓度应 ≥____________mol·L-1。