题目内容
6.向盛有硫酸铜水溶液的试管里滴加氨水,首先形成难溶物,继续滴加氨水,难溶物溶解,得到深蓝色的透明溶液,下列对此现象的说法正确的是( )| A. | 开始滴加氨水时形成的难溶物为Cu2 (OH)2 CO3 | |
| B. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+,配位数为4 | |
| C. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| D. | 在[Cu(NH3)4]2+中,Cu2+给出孤电子对,NH3提供空轨道 |
分析 氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液.
A.硫酸铜先和氨水反应生成氢氧化铜蓝色沉淀;
B.Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物;
C.硫酸铜先和氨水反应生成氢氧化铜,氢氧化铜和氨水反应生成络合物;
D.配合物中,配位体提供孤电子对,中心原子提供空轨道形成配位键.
解答 解:氨水呈碱性,向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物氢氧化铜,Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+,继续滴加氨水,难溶物溶解得到深蓝色的透明溶液,原因是氢氧化铜和氨水反应生成了铜氨络合物,反应为:Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH-.
A.硫酸铜和氨水反应生成氢氧化铜蓝色沉淀,反应为:Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+,故A错误;
B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+中,Cu2+为中心离子,电荷数为+2,NH3为配体,配位数为4,故B正确;
C.硫酸铜和氨水反应生成氢氧化铜蓝色沉淀,继续加氨水时,氢氧化铜和氨水继续反应生成络合物而使溶液澄清,铜离子转化到络合物离子中,所以溶液中铜离子浓度减小,故C错误;
D.在[Cu(NH3)4]2+离子中,铜离子含有空轨道,氨气分子含有孤电子对,所以Cu2+提供空轨道,NH3给出孤电子对,故D错误;
故选B.
点评 本题考查了配合物、配位键的形成等性质,题目难度中等,明确形成配合物的条件是:有提供空轨道的中心原子,有提供孤电子对的配位体.注意配位键属于共价键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.设NA表示阿伏德罗常数的值,下列叙述正确的是( )
| A. | 2.8g铁粉与50mL 4mol•L-1盐酸反应,转移电子的数目为0.15NA | |
| B. | 常温常压下,NA个CO2分子占有的体积为22.4L | |
| C. | 常温常压下,16g O2和O3混合气体中含有的氧原子数为NA | |
| D. | 1mol•L-1 AlCl3溶液中含有的Cl-数目为3NA |
17.据报道,科学家已成功合成了少量的O4,有关O4的说法正确的是( )
| A. | O4的摩尔质量是64g | |
| B. | O4与O3、O2互为同位素 | |
| C. | 相同质量的O4与O3所含原子个数之比为1:1 | |
| D. | 32gO4所含的电子数为32NA(NA为阿伏加德罗常数) |
14.下列物质是同学们生活中经常碰到的物质,其中属于纯净物的是( )
| A. | 水玻璃 | B. | 液氯 | C. | 漂白粉 | D. | 铝热剂 |
11.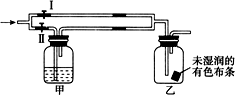 如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色,若关闭Ⅱ阀,打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色,若关闭Ⅱ阀,打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
①浓硫酸
②饱和氯化钠溶液
③亚硫酸钠溶液
④饱和碳酸氢钠溶液.
 如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色,若关闭Ⅱ阀,打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色,若关闭Ⅱ阀,打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )①浓硫酸
②饱和氯化钠溶液
③亚硫酸钠溶液
④饱和碳酸氢钠溶液.
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
18.TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料.
(1)实验室利用反应TiO2(s)+2CCl4(g)═TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如下:
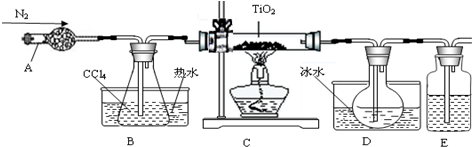
有关性质如表:
仪器A的名称是干燥管,装置E中的试剂是浓硫酸.反应开始前依次进行如下操作:①停止通氮气②熄灭酒精灯③冷却至室温.正确的顺序为②③①(填序号).欲分离D中的液态混合物,所采用操作的名称是蒸馏.
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶FeTiO3(s)+2H2SO4(aq)═FeSO4(aq)+TiOSO4(aq)+2H2O(l)
水解TiOSO4(aq)+2H2O(l)═H2TiO3(s)+H2SO4(aq)
简要工艺流程如下: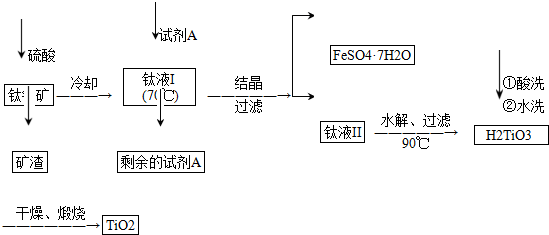
①试剂A为铁粉.钛液Ⅰ需冷却至70℃左右,若温度过高会导致产品收率降低,原因是由于TiOSO4容易水解,若温度过高,则会有较多TiOSO4水解为固体H2TiO3而经过滤进入FeSO4•7H2O中导致TiO2产率降低.
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是Fe2+.这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是Fe2O3(填化学式).
(1)实验室利用反应TiO2(s)+2CCl4(g)═TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如下:

有关性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶FeTiO3(s)+2H2SO4(aq)═FeSO4(aq)+TiOSO4(aq)+2H2O(l)
水解TiOSO4(aq)+2H2O(l)═H2TiO3(s)+H2SO4(aq)
简要工艺流程如下:

①试剂A为铁粉.钛液Ⅰ需冷却至70℃左右,若温度过高会导致产品收率降低,原因是由于TiOSO4容易水解,若温度过高,则会有较多TiOSO4水解为固体H2TiO3而经过滤进入FeSO4•7H2O中导致TiO2产率降低.
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是Fe2+.这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是Fe2O3(填化学式).
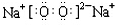 .
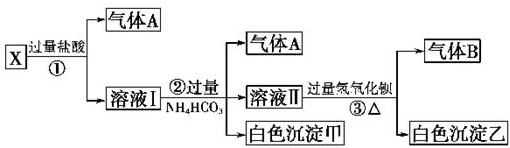
.
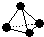 ,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.试判断相同条件下B4与B2的稳定性顺序是:N4<N2.
,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.试判断相同条件下B4与B2的稳定性顺序是:N4<N2.