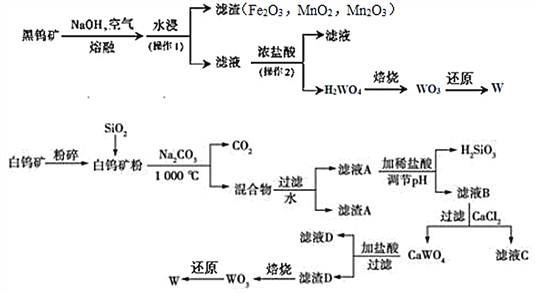
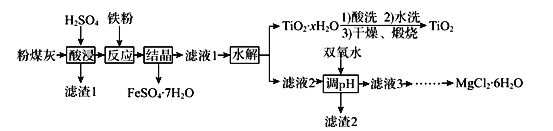
题目内容
【题目】25 ℃时,将 1.0 L w mol·L-1 CH3COOH 溶液与 0.1 mol NaOH固体混合,充分反应。然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),溶液pH的变化如图。下列叙述正确的是
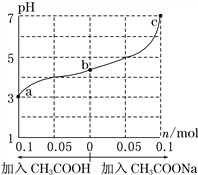
A. b点混合液中c(Na+)>c(CH3COO-)
B. 加入CH3COOH过程中,![]() 增大
增大
C. c点存在:c(CH3COOH)+c(CH3COO-) =0.1+w
D. a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b
【答案】C
【解析】A. 根据电荷守恒有c(Na+)+c(H+)=c(CH3COO-)+c(OH-),b点混合液中pH<7,则c(H+)>c(OH-),故c(Na+)<c(CH3COO-),选项A错误;B.加入CH3COOH过程中,c(CH3COO-)和c(H+)增大,c(OH-)减小,c(Na+)不变,![]() 减小,选项B错误;C. 根据物料守恒c点存在:c(CH3COOH)+c(CH3COO-) =0.1+w,选项C正确;D.溶液中酸或碱电离的氢离子或氢氧根离子的浓度越大,水的电离程度越小,a、b、c三点溶液中氢离子浓度依次减小,水的电离程度增大,所以水的电离程度由大到小的顺序的是c>b>a,选项D错误。答案选C。
减小,选项B错误;C. 根据物料守恒c点存在:c(CH3COOH)+c(CH3COO-) =0.1+w,选项C正确;D.溶液中酸或碱电离的氢离子或氢氧根离子的浓度越大,水的电离程度越小,a、b、c三点溶液中氢离子浓度依次减小,水的电离程度增大,所以水的电离程度由大到小的顺序的是c>b>a,选项D错误。答案选C。

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目