��Ŀ����
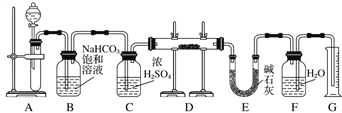
����Ŀ������һ��������Na2O���ʵ�Na2O2����������ͼ��ʵ��װ�òⶨNa2O2�����Ĵ��ȡ�(A�пɹ�ѡ�õ��Լ�ֻ��CaCO3���塢6 mol��L��1���ᡢ6 mol��L��1���������ˮ)
�ش��������⣺
��1��װ��A��Һ���Լ�ѡ��________ ��A�з�����Ӧ�����ӷ���ʽΪ______________��
��2��װ��B��������________________��װ��E�м�ʯ�ҵ�������_________________��
��3��װ��D�з�����Ӧ�Ļ�ѧ����ʽ_________________ �� _____________________��
��4������ʼʱ�����Ʒ������Ϊ2.0 g����Ӧ���������������Ϊ224 mL(��״��)����Na2O2�����Ĵ���Ϊ_____________��
���𰸡� 6 mol��L��1���� CaCO3 + 2H+== Ca2++CO2��+H2O ��ȥ�����е�HCl ����װ��D�з�Ӧʣ���CO2 2Na2O2��2CO2===2Na2CO3��O2 Na2O��CO2===Na2CO3 78%
�����������������������֪����ʵ������̼��������ᷴӦ��ȡ������̼��������̼���������������һ����������Ʒ��Ӧ������Ӧ������徭�Լ�ʯ������ʣ��Ķ�����̼����ˮ�������������ɵ�����������������������������Ʒ���������������Ʒ�Ĵ��ȡ�
��1��װ��A��Һ���Լ�ѡ��6 mol��L��1���ᣬA�з�����Ӧ�����ӷ���ʽΪCaCO3 + 2H+== Ca2++CO2��+H2O��
��2��װ��B�������dz�ȥ�����е�HCl��װ��E�м�ʯ�ҵ�����������װ��D�з�Ӧʣ���CO2��
��3��װ��D�з�����Ӧ�Ļ�ѧ����ʽ2Na2O2��2CO2===2Na2CO3��O2�� Na2O��CO2===Na2CO3��
��4������ʼʱ�����Ʒ������Ϊ2.0 g����Ӧ���������������Ϊ224 mL(��״��)����Ӧ���ɵ����������ʵ���n(O2)=0.01mol���ɴ˿��Լ����n(Na2O2)=2n(O2)=0.02mol��m(Na2O2)=1.56g����Na2O2�����Ĵ���Ϊ![]() 78%��
78%��