题目内容
【题目】下列各组离子中,能在溶液中大量共存的一组是( )
A.Mg2+、Al3+、Cl﹣、OH﹣
B.Na+、Ba2+、OH﹣、SO42﹣
C.K+、Na+、NO3﹣、HCO3﹣
D.K+、NH4+、CO32﹣、OH﹣
【答案】C
【解析】解:A.Mg2+、Al3+都与OH﹣发生反应,在溶液中不能大量共存,故A错误;
B.Ba2+、SO42﹣之间反应生成难溶物硫酸钡,在溶液中不能大量共存,故B错误;
C.K+、Na+、NO3﹣、HCO3﹣之间不发生反应,在溶液中能够大量共存,故C正确;
D.NH4+、OH﹣之间发生反应,在溶液中不能大量共存,故D错误;
故选C.

 阅读快车系列答案
阅读快车系列答案【题目】Ⅰ.CH4和CO2可以制造价值更高的化学产品。已知:
CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) ΔH 1=a kJ/mol
CO2(g)+2H2O(g) ΔH 1=a kJ/mol
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH 2=b kJ/mol
CO2(g)+H2(g) ΔH 2=b kJ/mol
2CO(g)+O2(g)![]() 2CO2(g) ΔH 3=c kJ/mol
2CO2(g) ΔH 3=c kJ/mol
(1)求反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH =______kJ/mol(用含a、b、c的代数式表示)。
2CO(g)+2H2(g) ΔH =______kJ/mol(用含a、b、c的代数式表示)。
(2)一定条件下,等物质的量的(1)中反应生成的气体可合成二甲醚(CH3OCH3),同时还产生了一种可参与大气循环的无机化合物,该反应的化学方程式为_______________。
Ⅱ.钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2Sx )分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
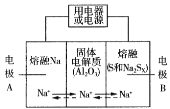
Na2Sx ![]() 2Na+xS (3<x<5)
2Na+xS (3<x<5)
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050 |
沸点/℃ | 892 | 444.6 | 2980 |
(3)根据上表数据,判断该电池工作的适宜温度应为______________(填字母序号)。
A.100℃以下 B.100℃~300℃
C.300℃~350℃ D.350℃~2050℃
(4)关于钠硫电池,下列说法正确的是______(填字母序号)。
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.充电时,电极A应连接电源的正极
D.充电时电极B的电极反应式为![]() 2e
2e![]() xS
xS
(5)25℃时,若用钠硫电池作为电源电解500mL 0.2mol/L NaCl溶液,当溶液的c(OH-)=0.1mol/L时,电路中通过的电子的物质的量为_________mol,两极的反应物的质量差为_________g。(假设电解前两极的反应物的质量相等)
III.(6)在标准状态即压力为100kPa,一定温度下,由元素最稳定的单质生成生成 1mol 纯化合物时的反应热称为该化合物的标准摩尔生成焓(ΔfHΘm)。已知 100kPa,一定温度下:
Fe2 O 3(s+3C(石墨)=2Fe(s)+3CO(g) △H=+490.0 kJ/mol
CO(g)+1/2O2(g)=CO2 (g) △H=-280.0kJ/mol
C(石墨)+O2 ( g)=CO2 (g) △H=-390.5kJ/mol
则 Fe2O3 的标准摩尔生成焓ΔfHΘm=__________________。
【题目】镍与VA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs),回答下列问题:
(1)基态Ga原子的核外电子排布式为_____,基态As原子核外有_________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为____和+3。砷的电负性比镍____(填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:________________________。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是___________________________________________。
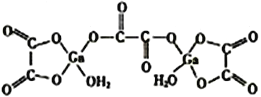
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为______,草酸根中碳原子的杂化方式为______________。
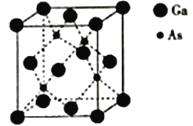
(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm。该晶体的类型为_________,晶体的密度为___________(设NA为阿伏加德罗常数的数值,列出算式即可)g·cm-3。
【题目】在下图所示实验装置中,向盛有溶液①和溶液②的试管中,通入过量气体X,最终溶液①、溶液②均无沉淀生成的是:

选项 | 气体X | 溶液① | 溶液② |
A | SO2 | Ca(OH)2 | BaCl2 |
B | Cl2 | AgNO3 | Na2S |
C | NH3 | AgNO3 | AlCl3 |
D | HCl | Na2SiO3 | NaAlO2 |
A. A B. B C. C D. D