题目内容
发生炉煤气是城市管道煤气中的一种重要气源,它的主要成分是CO,但由于CO有毒,所以煤气厂技术人员利用以下反应,将部分CO转换成H2:CO+H2O(g)(1)在一定条件下,上述反应达到平衡,则混合物中碳的氧化物中碳、氧元素的质量比m(C)∶m(O)可能为__________(填选项)。
A.3∶1 B.3∶4 C.3∶5 D.3∶8
(2)设CO的转化率为75%,则碳的氧化物中m(C)∶m(O)为_________。
(3)现用COx表示平衡混合物中碳的氧化物的组成,则表示x与反应CO+H2O(g)![]() CO2+H2中H2产率关系正确的是________(填图象序号)。
CO2+H2中H2产率关系正确的是________(填图象序号)。
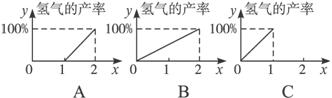
(1)C (2)3∶7 (3)A
解析:(1)CO中m(C)∶m(O)=3∶4,CO2中m(C)∶m(O)=3∶8,反应达到平衡时,混合物中COx的碳、氧质量比为![]() 。
。
(2)若CO的转化率为75%,则混合物中还有25%的CO没转化,
![]() 。
。
(3)依据化学方程式CO+H2O(g)![]() CO2+H2可知,COx中x的取值范围为1<x<2,只有x>1时,才有H2产生。因此A图正确。
CO2+H2可知,COx中x的取值范围为1<x<2,只有x>1时,才有H2产生。因此A图正确。

练习册系列答案
相关题目
 CO2(g)+H2(g) 将部分CO转换成H2。将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应,得到如下三组数据
CO2(g)+H2(g) 将部分CO转换成H2。将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应,得到如下三组数据