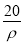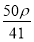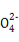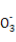题目内容
根据碘与氢气反应的热化学方程式
(ⅰ)I2(g)+H2(g)  2HI(g) ΔH=-9.48 kJ·mol-1
2HI(g) ΔH=-9.48 kJ·mol-1
(ⅱ)I2(s)+H2(g)  2HI(g) ΔH=+26.48 kJ·mol-1
2HI(g) ΔH=+26.48 kJ·mol-1
下列判断正确的是( )
A.1 mol I2(s)中通入2 g H2(g),反应吸热26.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(ⅱ)的反应物总能量比反应(ⅰ)的反应物总能量低
D.反应(ⅰ)放出的热量多,所以产物的能量低,比反应(ⅱ)的产物更稳定
C
【解析】A项,I2(s)和H2(g)的反应是可逆反应;B项,I2(g)=I2(s) ΔH=-35.96 kJ·mol-1,所以1 mol I2(s)和1 mol I2(g)所含能量相差35.96 kJ;C项,固态碘稳定,能量低;D项,(ⅰ)、(ⅱ)中HI均为气体,能量一样,也一样稳定。

根据物质的组成和性质将下列无机化合物进行了分类。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①H2SO4 ②______ | ③NaOH ④______ | ⑤Na2SO4 ⑥______ | ⑦SO2 ⑧Na2O | ⑨HCl ⑩_____ |
(1)请仔细观察表格中的物质类别,从K、H、O、C、N五种元素中任选两种或三种组成合适的物质,将化学式分别填在表中②、④、⑥、⑩后面的横线上。
(2)⑦和⑧可发生非氧化还原反应,生成一种盐。该反应的化学方程式为________________________________________________________________________。
(3)将⑦通入③的溶液中,反应的离子方程式为_______________________________________。
(4)⑨极易溶于水并电离出氯离子,大多数含氯离子的盐溶于水后也能电离出氯离子。检验溶液中氯离子的方法是_____________________________________________。