题目内容
为消除氮的氧化物(NOx)对大气的污染,工业上通常利用反应NOx+NH3→N2+H2O来保护环境。现有NO2和NO的混合气体3L,可用3.5LNH3恰好使其完全转化为N2,则混合气体中NO2和NO的体积之比为()。A.1∶4 B.1∶1 C.2∶1 D.3∶1
D
【试题分析】
此题以消除氮氧化物对大气的污染为背景,考查同学们的化学计算技能。
元素守恒法。由题意知,NOx+NH3→N2+H2O是一个氧化还原反应。通过化学方程式的配平可以很快得到答案。设NO2的系数为a,NO的系数为(3-a),则NH3的系数为3.5,有:aNO2+(3-a)NO+3.5NH3=3.25N2+(a+3)H2O,根据氢元素守恒有:3.5×3=(a+3)×2,a=2.25,所以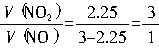

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
 中M+中所有电子正好充满K、L、M三个电子层,它M+的符号是 ,与同一个N3-相连的M+有 个。
中M+中所有电子正好充满K、L、M三个电子层,它M+的符号是 ,与同一个N3-相连的M+有 个。