题目内容
【题目】H2S是存在于燃气中的一种有害气体,脱除H2S的方法有很多。
(1)国内有学者设计了“Cu2+一沉淀氧化”法脱除H2S。该法包括生成CuS沉淀,氧化CuS(Cu2++CuS+4Cl—=S+2CuCl2—)及空气氧化CuCl2—再生Cu2+。
①反应H2S(aq)+Cu2+(aq)CuS(s)+2H+(aq)的K=__________
②再生Cu2+反应的离子方程式为____________。
(2)采用生物脱硫技术时,H2S与碱反应转化为HS-,在脱氮硫杆菌参与下,HS-被NO3-氧化为SO42—、NO3—被还原为N2。当33.6 m3(标准状况)某燃气(H2S的含量为0.2%)脱硫时,消耗NO3—的物质的量为___mol。
(3)已知下列热化学方程式:
Ⅰ.H2(g)+![]() O2(g)=H2O(l) H1=-285.8kJmol-1
O2(g)=H2O(l) H1=-285.8kJmol-1
Ⅱ. H2(g)+S(s)=H2S(g) H2=-20.6kJmol-1
Ⅲ.S(s)+O2(g)=SO2(g) H3=-296.8kJmol-1
则以Claus法脱除H2S的反应:2H2S(g)+SO2 (g)=3S(s)+2H2O(1) △H=________kJ/mol。
(4)101 kPa下,H2S分解:2H2S(g) 2H2(g)+S2(g)。保持压强不变,反应达到平衡时,气体的体积分数(φ)随温度的变化曲线如图:
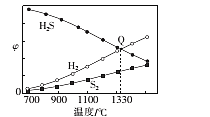
①在密闭容器中,关于反应2H2S(g) 2H2(g)+S2 (g)的说法正确的是____(填字母)。
A.Kp随温度的升高而增大
B.低压有利于提高HpS的平衡分解率
C.维持温度、气体总压强不变时,向平衡体系中通入氩气,则v(正)<v(逆)
D.在恒容密闭容器中进行反应,当气体密度不再变化时,反应达到平衡状态
②图中Q点:H2S的平衡转化率为____;S2(g)的分压为____kPa;1330℃时,反应2H2S(g) 2H2(g)+S2(g)的Kp=_____(Kp为以分压表示的平衡常数)。
【答案】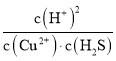 4CuCl2—+O2+ 4H+= 4Cu2++2 H2O+8Cl- 4.8 -233.6 AB 50% 20.2 kPa 20.2 kPa
4CuCl2—+O2+ 4H+= 4Cu2++2 H2O+8Cl- 4.8 -233.6 AB 50% 20.2 kPa 20.2 kPa
【解析】
(1) ①根据平衡常数表达式,反应H2S(aq)+Cu2+(aq)CuS(s)+2H+(aq)的K=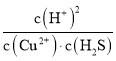 ;
;
②空气氧化CuCl2—再生Cu2+;
(2) H2S与碱反应转化为HS-,根据硫原子守恒:H2S~ HS-;在脱氮硫杆菌参与下,HS-被NO3-氧化为SO42—、NO3—被还原为N2,发生的离子反应为5HS-+8NO3-+3H+= 5SO42-+ 4N2+ 4H2O,则可得关系:5H2S~ 5HS-~8NO3-,根据硫化氢的物质的量进行计算;
(3)根据盖斯定律,Ⅰ×2-Ⅱ×2-Ⅲ即可得到目标反应的焓变,即△H=2H1-2H2-H3;
(4)①A.平衡常数只受温度影响,根据图像,随着温度升高,H2S 的体积分数减少,硫和氢气的体积分数增大,反应向正向进行,则Kp随温度的升高而增大;
B. 反应2H2S(g) 2H2(g)+S2(g)正反应方向为气体体积增大的方向,根据勒夏特列原理,降低压强平衡向体积增大的方向移动,即平衡向正反应方向移动,H2S的平衡分解率增大,则降低压强低压有利于提高H2S的平衡分解率;
C.维持温度、气体总压强不变时,向平衡体系中通入氩气,相当于增大容器体积,平衡向气体体积增大的方向移动,即向正向移动,则v(正>v(逆);
D.在恒容密闭容器中进行反应,容器体积不变,反应过程中气体总质量不变,气体密度始终保持不变,则密度不再变化不能判断作为判断反应达到平衡状态的依据;
②图中Q点时,硫化氢的体积分数与氢气的体积分数相等,设硫化氢转化率为x,硫化氢初始物质的量为1mol,则利用三段式计算解答。
(1) ①根据平衡常数表达式,反应H2S(aq)+Cu2+(aq)CuS(s)+2H+(aq)的K=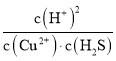 ;
;
②空气中的氧气可氧化CuCl2—生成Cu2+,则离子反应为:4CuCl2—+O2+ 4H+= 4Cu2++ 2H2O+8Cl-;
(2) 33.6 m3(标准状况)某燃气(H2S的含量为0.2%)中含有硫化氢的物质的量=![]() =3mol;H2S与碱反应转化为HS-,根据硫原子守恒:H2S~ HS-;在脱氮硫杆菌参与下,HS-被NO3-氧化为SO42—、NO3—被还原为N2,发生的离子反应为5HS-+8NO3-+3H+= 5SO42-+ 4N2+ 4H2O,则可得关系:5H2S~ 5HS-~8NO3-,则消耗NO3—的物质的量=
=3mol;H2S与碱反应转化为HS-,根据硫原子守恒:H2S~ HS-;在脱氮硫杆菌参与下,HS-被NO3-氧化为SO42—、NO3—被还原为N2,发生的离子反应为5HS-+8NO3-+3H+= 5SO42-+ 4N2+ 4H2O,则可得关系:5H2S~ 5HS-~8NO3-,则消耗NO3—的物质的量=![]() =4.8mol;
=4.8mol;
(3)根据盖斯定律,Ⅰ×2-Ⅱ×2-Ⅲ即可得到目标反应的焓变,即△H=2H1-2H2-H3=2×(-285.8kJmol-1)-2×(-20.6kJmol-1)-(-296.8kJmol-1)=-233.6kJmol-1,2H2S(g)+SO2 (g)=3S(s)+2H2O(1)△H=-233.6 kJmol-1;
(4)①A.平衡常数只受温度影响,根据图像,随着温度升高,H2S 的体积分数减少,硫化氢气的体积分数增大,反应向正向进行,则Kp随温度的升高而增大,故A正确;
B. 反应2H2S(g)2H2(g)+S2(g)正反应方向为气体体积增大的方向,根据勒夏特列原理,降低压强平衡向体积增大的方向移动,即平衡向正反应方向移动,H2S的平衡分解率增大,则降低压强低压有利于提高H2S的平衡分解率,故B正确;
C.维持温度、气体总压强不变时,向平衡体系中通入氩气,相当于增大容器体积,平衡向气体体积增大的方向移动,即向正向移动,则v(正)>v(逆),故C错误;
D.在恒容密闭容器中进行反应,容器体积不变,反应过程中气体总质量不变,气体密度始终保持不变,则密度不再变化不能判断作为判断反应达到平衡状态的依据,故D错误;
故答案选AB;
②图中Q点时,硫化氢的体积分数与氢气的体积分数相等,设硫化氢转化率为x,硫化氢初始物质的量1mol,则利用三段式:。

图中Q点时,硫化氢的体积分数与氢气的体积分数相等,则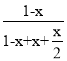 =
=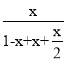 ,则x=
,则x=![]() ,则H2S的平衡转化率为50%;S2(g)的分压为
,则H2S的平衡转化率为50%;S2(g)的分压为![]() ×101 kPa=20.2 kPa,1330℃时,反应2H2S(g)=2H2(g)+S2(g)的Kp=
×101 kPa=20.2 kPa,1330℃时,反应2H2S(g)=2H2(g)+S2(g)的Kp=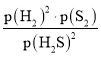 =
=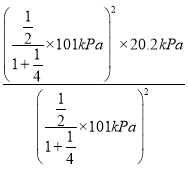 =20.2 kPa。
=20.2 kPa。

【题目】中国制造彰显中国力量,在电影《厉害了,我的国》中重点介绍了中国制造的重点工程,下列所涉及的材料不属于无机非金属材料的是( )
世界最大射电望远镜“中国天眼” |
“嫦娥四号”月球探测器 |
中国大飞机C919 |
中国第一艘深海载人潜水器“蛟龙号” |
A.光导纤维传输线 | B.晶体硅芯片 | C.新型铝锂合金机翼 | D.氮化硅陶瓷发动机 |
A.AB.BC.CD.D