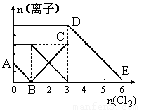
题目内容
 向含有Fe2+、I-、Br-的溶液中缓慢通入氯气,溶液中各种离子的物质的量变化如图,正确的是( )
向含有Fe2+、I-、Br-的溶液中缓慢通入氯气,溶液中各种离子的物质的量变化如图,正确的是( )分析:氧化还原反应中氧化剂的氧化性>氧化产物的氧化性,还原剂的还原性>还原产物的还原性,氧化剂先氧化还原性强的离子,再氧化还原性弱的离子,还原性I->Fe2+>Br-,通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,结合图象解答该题.
解答:解:A.还原性I->Fe2+>Br-,B点时溶液中I-完全反应,溶液中存在Fe2+和Br-,故A错误;
B.根据还原性强弱可知,DE段应为Br-的物质的量的变化,故B错误;
C.由消耗氯气的量可知,碘离子的物质的量为2mol,亚铁离子是4mol,溴离子的物质的量是6mol,n(Fe2+):n(I-):n(Br-)=2:1:3,故C错误;
D.当通入2molCl2时,2mol的I-消耗氯气1mol,余下的1mol氯气再与2molFe2+反应,即溶液中发生的离子反应可表示为2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-,故D正确.
故选D.
B.根据还原性强弱可知,DE段应为Br-的物质的量的变化,故B错误;
C.由消耗氯气的量可知,碘离子的物质的量为2mol,亚铁离子是4mol,溴离子的物质的量是6mol,n(Fe2+):n(I-):n(Br-)=2:1:3,故C错误;
D.当通入2molCl2时,2mol的I-消耗氯气1mol,余下的1mol氯气再与2molFe2+反应,即溶液中发生的离子反应可表示为2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-,故D正确.
故选D.
点评:本题考查氧化还原反应,题目难度中等,本题注意把握物质还原性的强弱,易错点为C和D,注意把握图象的曲线变化的特点.

练习册系列答案
相关题目
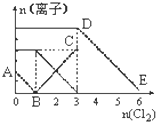 向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.有关说法不正确的是( )
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.有关说法不正确的是( )| A、线段BC代表Fe3+物质的量的变化情况 | B、原混合溶液中n(FeBr2)=3mol | C、当通入Cl2 2mol时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2C12=2Fe3++I2+4Cl- | D、原溶液中n(Fe2+):n(I-):n(Br-)=3:1:2 |
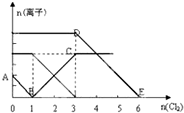 向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.有关说法正确的是( )
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.有关说法正确的是( )| A、线段AB代表Fe2+物质的量的变化情况 | B、原混合溶液中 c(FeBr2)=6mol/L | C、DE段的离子反应可表示为2Br-+Cl2=Br2+2Cl- | D、原溶液中n(Fe2+):n(I-):n(Br-)=2:2:3 |
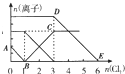 (2013?安徽模拟)向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化曲线如图所示.有关说法不正确的是( )
(2013?安徽模拟)向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化曲线如图所示.有关说法不正确的是( )