题目内容
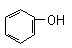
(10分)能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
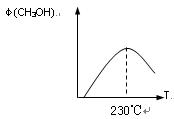
(1)合成甲醇的反应为:CO(g)+2H2(g)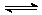 CH3OH(g)△H;右图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H
CH3OH(g)△H;右图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H
0(填“>、<或= ”)
(2)若在230℃时,平衡常数K=1。若其它条件不变,将温度升高到500℃时,达到平衡时,K 1 (填“>、<或= ”)
(3)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的 倍。
(4)利用甲醇燃料电池设计如右图所示的装置:则该装置中Cu极为 极。
①写出b极的电极反应式 。
②当铜片的质量变化为12.8 g时:a极上消耗的O2在标准状况下的体积为 L。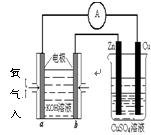
(1)合成甲醇的反应为:CO(g)+2H2(g)
 CH3OH(g)△H;右图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H
CH3OH(g)△H;右图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H 0(填“>、<或= ”)

(2)若在230℃时,平衡常数K=1。若其它条件不变,将温度升高到500℃时,达到平衡时,K 1 (填“>、<或= ”)
(3)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的 倍。
(4)利用甲醇燃料电池设计如右图所示的装置:则该装置中Cu极为 极。
①写出b极的电极反应式 。
②当铜片的质量变化为12.8 g时:a极上消耗的O2在标准状况下的体积为 L。

(1)<(2分)
(2)<(1分)
(3)0.55(2分)
(4)阳(1分)
①CH3OH+8OH--6e-==CO2-3+6H2O(2分)
②2.24(2分)
略

练习册系列答案
相关题目