题目内容
10.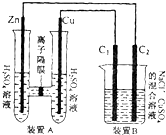 有如图装置:回答下列问题:
有如图装置:回答下列问题:(1)装置A是原电池,B是电解池.
(2)装置A中的Zn极是负极,Cu极上的电极反应方程式为:2H++2e-=H2↑.
(3)锌与铁组成的合金在潮湿的空气中,锌被腐蚀而另一种金属被保护,这种保护方法叫做牺牲阳极的阴极保护法,正极反应式为O2+4e-+2H2O=4OH-.
(4)装置B中是浓度均为0.1mol/L的NaCl、CuSO4混合溶液,溶液体积为500mL.当装置A中Zn棒质量减少3.25g时,C2上质量增加3.2g.
分析 (1)A能自发的进行氧化还原反应而作原电池,B连接外接电源属于电解池;
(2)原电池中,易失电子的金属锌作负极,铜作正极,正极上氢离子得电子发生还原反应;
(3)锌与铁组成的合金在潮湿的空气中能够形成原电池,Zn为负极,Fe为正极,正极上氧气得电子生成氢氧根离子;
(4)根据转移电子相等及溶液中铜离子的物质的量计算C2上质量增加量.
解答 解:(1)A能自发的进行氧化还原反应而作原电池,B连接外接电源属于电解池,
故答案为:原电;电解;
(2)原电池中,易失电子的金属锌作负极,铜作正极,正极上氢离子得电子发生还原反应而生成氢气,电极反应式为:2H++2e-=H2↑,
故答案为:负;2H++2e-=H2↑;
(3)锌与铁组成的合金在潮湿的空气中能够形成原电池,Zn为负极,失电子生成锌离子,Fe为正极,正极上氧气得电子生成氢氧根离子,Fe得到保护,称为牺牲阳极的阴极保护法,正极电极反应式为O2+4e-+2H2O=4OH-,故答案为:牺牲阳极的阴极保护法;O2+4e-+2H2O=4OH-;
(4)C1作阳极,C2作阴极,电解氯化钠和硫酸铜混合溶液时,阳极上氯离子放电生成氯气,阴极上铜离子放电生成铜,串联电路中转移电子数相等,3.25gZn失电子物质的量$\frac{3.25g}{65g/mol}$×2=0.1mol,能够析出Cu0.05mol,溶液中铜离子的物质的量=0.1mol/L×0.5L=0.05mol,所以析出铜的质量是0.05mol×64g/mol=3.2g,故答案为:3.2.
点评 本题考查了原电池和电解池原理,正确判断正、负极和阴、阳极是解本题关键,难度中等.

练习册系列答案
相关题目
18.下列说法错误的是( )
| A. | 无论固体、液体还是气体的燃烧反应,都是△H<O | |
| B. | 吸热反应的逆反应一定是放热反应 | |
| C. | 碳在完全燃烧时,生成CO2放出的热量比不完全燃烧生成CO放出的热量多 | |
| D. | H2是一种理想的绿色能源,是因为燃烧1molH2所放出的能量特别大 |
5.重庆市天原化工厂2006年4月16日发生特大氯气泄漏和三氯化氮爆炸事故,造成多人死亡和失踪.已知三氯化氮分子结构与氨相似,下列有关说法不正确的是( )
| A. | 消除储气罐上空泄漏出的高浓度氯气,可喷洒碱液 | |
| B. | 发生氯气泄漏时,附近人员可用浸有碳酸钠溶液的毛巾捂住鼻孔进行自我保护 | |
| C. | 氯气能腐蚀金属及非金属材料,这种腐蚀主要属于电化学腐蚀 | |
| D. | 三氯化氮分子是极性分子 |
5.下列各溶液中,各离子可能大量共存的有( )
| A. | 含有大量Ba2+的溶液中:HCO3-、Fe3+、Na+、SCN- | |
| B. | 由水电离的c(OH-)=10-14mol•L-1 的溶液中:S2-、Cl-、Na+、K+ | |
| C. | 滴加无色酚酞试液后仍无色的溶液中:Na+、CO32-、K+、ClO-、AlO2- | |
| D. | 加入铝粉后产生氢气的溶液中:NH4+、Na+、NO3-、Cl-、S2- |
 某校化学研究性学习小组,在学习了金属的知识后,探究Cu的常见化合物性质.过程如下:
某校化学研究性学习小组,在学习了金属的知识后,探究Cu的常见化合物性质.过程如下: ;若其不能与氢气发生加成反应,它可能为立方烷,其二氯代物有3种.
;若其不能与氢气发生加成反应,它可能为立方烷,其二氯代物有3种.