题目内容
【题目】Na2O2具有强氧化性,可以用来漂白纺织类物品、麦杆、纤维等.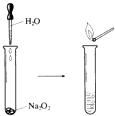
(1)Na2O2中O元素的化合价为 .
(2)如图所示实验,滴入几滴水,现象是 , 反应的化学方程式为 . 实验结束后,向试管所得溶液中滴加酚酞溶液,现象是 .
(3)若用嘴通过导管向附着少量Na2O2粉末的棉花吹气,棉花燃烧.原因是Na2O2与H2O和CO2反应,其中与CO2反应的化学方程式为 . 若标准状况下反应生成了5.6L O2 , 则转移电子的物质的量为mol.
【答案】
(1)-1
(2)剧烈反应,产生气泡,试管口带火星的木条复燃;2Na2O2+2H2O=4NaOH+O2↑;先变红后褪色
(3)2Na2O2+2CO2=2Na2CO3+O2;0.5
【解析】解:(1)钠显+1价,设化合物Na2O2中O元素化合价为x,根据化合物中各元素化合价代数和为零,则(+1)×2+2x=0,解得x=﹣1,所以答案是:﹣1;(2)过氧化钠和水反应生成氢氧化钠和氧气,即2Na2O2+2H2O=4NaOH+O2↑,向试管所得溶液中滴加酚酞溶液,体系呈碱性,溶液变红,产生氧气,具有氧化性,故将溶液漂白,所以现象是剧烈反应,产生气泡,试管口带火星的木条复燃,所以答案是:剧烈反应,产生气泡,试管口带火星的木条复燃;2Na2O2+2H2O=4NaOH+O2↑;先变红后褪色;(3)因为过氧化钠和水以及二氧化碳反应都会生成氧气,氧气具有助燃性,过氧化钠和二氧化碳反应生成碳酸钠和氧气,即2Na2O2+2CO2=2Na2CO3+O2↑,每生成1mol氧气,转移2mol电子,所以生成 ![]() =0.25mol氧气转移0.5mol电子,所以答案是:2Na2O2+2CO2=2Na2CO3+O2↑;0.5.
=0.25mol氧气转移0.5mol电子,所以答案是:2Na2O2+2CO2=2Na2CO3+O2↑;0.5.

练习册系列答案
相关题目
