题目内容
1.一种熔融碳酸盐燃料电池原理示意如图.电极A发生的电极反应为:H2+CO+2CO32--4e-=H2O+3CO2.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-.
分析 由图可知:燃料电池工作时,燃料在负极失电子发生氧化反应,氧气在正极得电子发生还原反应,则A为负极,B为正极,负极上CO和H2失电子被氧化生成二氧化碳和水,正极上为氧气得电子与二氧化碳反应生成CO32-,据此解答.
解答 解:燃料电池工作时,负极上CO和H2失电子被氧化生成二氧化碳和水,则电极A反应为:H2+CO+2CO32--4e-=H2O+3CO2;B为正极,正极为氧气得电子与二氧化碳反应生成CO32-,电极反应为:O2+2CO2+4e-=2CO32-,
故答案为:H2+CO+2CO32--4e-=H2O+3CO2;O2+2CO2+4e-=2CO32-.
点评 本题考查燃料电池电极反应式的书写,为高频考点,明确原电池的工作原理是解题的关键,注意熔融电解质和电解质溶液的区别,题目难度中等.

练习册系列答案
相关题目
2.下列以高粱为主要原料的酿醋工艺中,利用醋酸溶解性的是( )
| A. |  蒸拌原料 蒸拌原料 | B. |  淀粉发酵 淀粉发酵 | C. |  用水浸淋 | D. |  放置陈酿 放置陈酿 |
3.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 用pH试纸检测:0.1mol•L-1Na2SO3溶液、0.1mol•L-1NaHSO3溶液 | Na2SO3溶液的pH 约为10;NaHSO3 溶液的pH约为5 | HSO3-结合H+的能力比SO32-强 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | Na2CO3溶液中存在水解平衡 |
| C | 注射器中吸入NO2,封堵针尖处,将注射器体积压缩为原来的一半 | 气体颜色比起始时浅 | 加压后,NO2转变为无色的N2O4 |
| D | 饱和BaSO4悬浊液中加入饱和Na2CO3溶液,振荡,然后过滤、洗涤,向所得固体中加入盐酸 | 沉淀部分溶解且有 气体产生 | Ksp(BaSO4)> Ksp(BaCO3) |
| A. | A | B. | B | C. | C | D. | D |
16.如图所示与对应叙述相符的是( )
| A. |  图表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)<Ksp(CuS) | |
| B. |  图表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸 | |
| C. |  图表示用0.l0 mol•L-1NaOH溶液滴定25.00 mL盐酸的滴定曲线,则c(HCl)=0.08mol•L-1 | |
| D. |  图表示反应N2(g)+3H2(g)?2NH3(g)平衡时NH3体积分数随起始$\frac{n({N}_{2})}{n({H}_{2})}$,变化的曲线,则转化率:αA(H2)=αB(H2) |
13.下列过程属于物理变化的是( )
| A. | 煤的液化 | B. | 石油的分馏 | C. | 石油裂化 | D. | 乙烯加聚反应 |
10.一定温度下,在三个体积均为1.0L 的恒容密闭容器中发生反应:2A(g)?B(g)+C(g)△H
下列说法不正确的是( )
| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| A(g) | B(g) | C(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
| A. | 该反应的正反应为△H<0 | |
| B. | 207℃,K=4 | |
| C. | 达到平衡时,容器Ⅰ中的A体积分数与容器Ⅱ中的相同 | |
| D. | 容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的短 |
11.下列物质含有离子键的是( )
| A. | H2 | B. | NaCl | C. | HCl | D. | H2O |

 ;
; ;
; .
. .
. .
. 和
和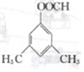 .
. . 仿照上述流程,设计以苯、乙醛为有机原料(无机试剂任选)制备某药物中间体
. 仿照上述流程,设计以苯、乙醛为有机原料(无机试剂任选)制备某药物中间体 的合成路线:
的合成路线: .
.