题目内容
【题目】铁、钴(Co)、镍(Ni)是同族元素,都是较活泼的金属,它们的化合物在工业上有重要的应用.
(1)草酸钴(CoCO)是一种难溶于水的浅粉红色粉末,通常用硫酸钴溶液和草酸铵溶液反应制得,写出该反应的离子方程式:
(2)现将含0.5mol FeCl3的溶液和含0.5mol KSCN的溶液混合,混合后溶液体积为1L,已知溶液存在平衡:Fe3++SCN﹣Fe(SCN)2+(忽略其它过程).平衡浓度c[Fe(SCN)2+]与温度T的关系如图1所示:则该反应△H0(填“>”或“<”),温度为T1时,反应在5秒钟时达到平衡,平衡时c[Fe(SCN)2+]=0.45mol/L,求达到平衡时的平均反应速率
v(SCN﹣)=molL﹣1S﹣1 , 该温度下的Fe3+的平衡转化率为 , 该温度下反应的平衡常数为 . 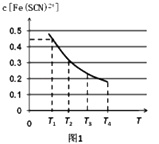
(3)已知某溶液中,Co2+、Ni2+的浓度分别为0.60mol/L和1.2mol/L,取一定量的该溶液,向其中滴加NaOH溶液,当Co(OH)2开始沉淀时,溶液中 ![]() 的值等于 . (取两位有效数字)
的值等于 . (取两位有效数字)
(已知Ksp[Co(OH)2]=6.0×10﹣15 , Ksp[Ni(OH)2]=2.0×10﹣15)
(4)工业上还可用通过电解浓NaOH溶液制备Na2FeO4 , 其工作原理如图2所示,则阳极的电极反应式为 . 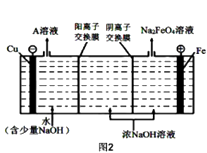
【答案】
(1)C?O?2﹣+Co2+=CoC?O?↓
(2)<;0.09;90%;180
(3)3.0
(4)Fe+8OH﹣﹣6e﹣=FeO42﹣+4H2O
【解析】解:(1)硫酸钴溶液和草酸铵溶液发生复分解反应生成难溶的草酸钴,反应的离子方程式为CO2﹣+Co2+=CoCO↓,所以答案是:CO2﹣+Co2+=CoCO↓;(2)根据平衡移动原理可知,升高温度平衡向吸热的反应方向移动,根据图可知,升高温度,c[Fe(SCN)2+]的值减小,所以△H<0,反应在5秒钟时达到平衡,平衡时c[Fe(SCN)2+]=0.45mol/L,则达到平衡时的平均反应速率v(SCN﹣)=v[Fe(SCN)2+]= ![]() molL﹣1S﹣1=0.09molL﹣1S﹣1 , 参加反应的Fe3+的物质的量为0.45mol,所以Fe3+的转化率=
molL﹣1S﹣1=0.09molL﹣1S﹣1 , 参加反应的Fe3+的物质的量为0.45mol,所以Fe3+的转化率= ![]() ×100%=90%,平衡时各物质的浓度为:c(Fe3+)=c(SCN﹣)=0.05mol/L,c[Fe(SCN)2+]=0.45mol/L,所以平衡常数K=
×100%=90%,平衡时各物质的浓度为:c(Fe3+)=c(SCN﹣)=0.05mol/L,c[Fe(SCN)2+]=0.45mol/L,所以平衡常数K= ![]() =180,
=180,
所以答案是:<;0.09;90%;180;(3)Ksp[Co(OH)2]=6.0×10﹣15 , Ksp[Ni(OH)2]=2.0×10﹣15 , 对于同种类型的沉淀,Ksp越小,越难溶,则在滴加氢氧化钠溶液的过程中,二价镍离子先沉淀,Ni2++2OH﹣=Ni(OH)2↓,
当Co2+开始沉淀时,溶液中存在两个溶解平衡:CO(OH)2CO2++2OH﹣ , Ni(OH)2Ni2++2OH﹣ ,
根据Ksp[Co(OH)2]计算出此时溶液中c(OH﹣),c(OH﹣)= ![]() =
= ![]() =10﹣7mol/L,
=10﹣7mol/L,
则溶液中剩下的镍离子浓度c(Ni2+)= ![]() =
= ![]() =0.2mol/L,溶液中
=0.2mol/L,溶液中 ![]() =
= ![]() =3.0,
=3.0,
所以答案是:3.0;(4)阳极是铁,故阳极上铁放电生成FeO42﹣ , 由于是碱性环境,故电极方程式为:Fe+8OH﹣﹣6e﹣=FeO42﹣+4H2O,
所以答案是:Fe+8OH﹣﹣6e﹣=FeO42﹣+4H2O.
【考点精析】关于本题考查的化学平衡状态本质及特征和化学平衡的计算,需要了解化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能得出正确答案.