题目内容
(每空2分,16分)生活中的有机物种类丰富,在衣食住行等多方面应用广泛,其中乙醇是比较常见的有机物。
(1)乙醇是无色有特殊香味的液体,密度比水_________。
(2)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为________________ (不用写反应条件),原子利用率是_________ 。
(3)下列属于乙醇的同系物的是_____,属于乙醇的同分异构体的是_____。(选填编号)
(4)乙醇能够发生氧化反应:
① 46 g乙醇完全燃烧消耗__________mol氧气。
②乙醇在铜做催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为_____________。
③下列说法正确的是__________。(选填字母)
| A.乙醇不能和酸性高锰酸钾溶液发生氧化还原反应 |
| B.交警用橙色的酸性重铬酸钾溶液检查司机是否酒后驾车 |
| C.黄酒中某些微生物使乙醇氧化为乙酸,于是酒就变酸了 |
| D.陈年的酒很香是因为乙醇和乙醇被氧化生成的乙酸发生酯化反应生成了乙酸乙酯 |
(1)小
(2)CH2=CH2+H2O CH3CH2OH
CH3CH2OH
(3)D ,E
(4)① 3 ②2C2H5OH+O2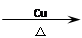 2CH3CHO+2H2O ③BCD
2CH3CHO+2H2O ③BCD
解析

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案(每空2分 共16分) 20世纪50年代科学家提出价层电子对互斥模型(简称VSEPR模型),用于预测简单分子立体结构。其要点可以概括为:
Ⅰ、用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤对电子),(n+m)称为价层电子对数。分子中的价层电子对总是互相排斥,均匀的分布在中心原子周围的空间;
Ⅱ、分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子; Ⅲ、分子中价层电子对之间的斥力主要顺序为: i、孤对电子之间的斥力>孤对电子对与共用电子对之间的斥力>共用电子对之间的斥力; ii、双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力; iii、X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强; iv、其他。
请仔细阅读上述材料,回答下列问题:
(1)根据要点I可以画出AXnEm的VSEPR理想模型,请填写下表:
|
n+m |
2 |
|
|
VSEPR理想模型 |
|
正四面体 |
|
价层电子对之间的理想键角 |
|
109°28′ |
(2)请用VSEPR模型解释CO2为直线型分子的原因 。
(3) H2O分子的立体构型为: ,请你预测水分子中∠H-O-H的大小范围为 ,原因是 。
(4) SO2Cl2和SO2F2都属AX4E0型分子,S=O之间以双键结合,S-Cl、S-F之间以单键结合。请你预测 SO2Cl2和SO2F2分子的立体构型: 。
