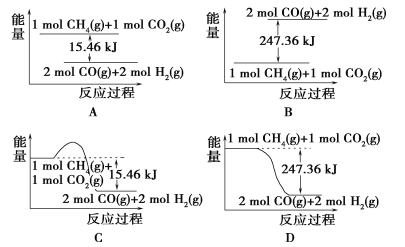
��Ŀ����
����Ŀ����֪��Ӧ2CH3OH(g) ![]() CH3OCH3(g)��H2O(g)��ij�¶��µ�ƽ�ⳣ��Ϊ400�����¶��£����ܱ������м���CH3OH����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
CH3OCH3(g)��H2O(g)��ij�¶��µ�ƽ�ⳣ��Ϊ400�����¶��£����ܱ������м���CH3OH����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
���� | CH3OH | CH3OCH3 | H2O |
Ũ��(mol��L��1) | 0.44 | 0.6 | 0.6 |
(1)�Ƚϴ�ʱ�����淴Ӧ���ʵĴ�С��v��________v��(�>������<������)��
(2)������CH3OH��10 min��Ӧ�ﵽƽ�⣬��ʱc(CH3OH)��________����ʱ���ڷ�Ӧ����v(CH3OH)��________��CH3OH��ת����Ϊ________��
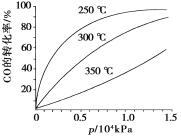
(3)CO�����ںϳɼ״�����Ӧ����ʽΪCO(g)��2H2(g)===CH3OH(g)��CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ����ͼ��ʾ���÷�Ӧ��H________0(�>����<��)��ʵ����������������250����1.3��104kPa���ң�ѡ���ѹǿ��������___________________��
���𰸡�(1)> (2)0.04 mol��L��1 0.16 mol��L��1��min��1 97.6%
(3)< ��250����1.3��104kPaʱ��CO��ת�����ѽϸߣ�������ѹǿ��CO��ת���ʱ仯����ͬʱ�����ɱ�����
��������(1)�÷�Ӧ��Ũ���̱���ʽΪQ��![]() ��������Ũ�ȴ���Ũ���̱���ʽ��Q��
��������Ũ�ȴ���Ũ���̱���ʽ��Q��![]() ��1.86<400���ʷ�Ӧ������Ӧ������У�����Ӧ���ʴ����淴Ӧ���ʡ�
��1.86<400���ʷ�Ӧ������Ӧ������У�����Ӧ���ʴ����淴Ӧ���ʡ�
(2)�������и�����ijʱ�̸����Ũ�ȣ���֪��ʼʱ�����CH3OH��Ũ��Ϊ0.44 mol��L��1��1.2 mol��L��1��1.64 mol��L��1���л�ѧƽ������ʽ����ת����CH3OH��Ũ��Ϊ2x mol��L��1��
2CH3OH(g) ![]() CH3OCH3(g)��H2O(g)
CH3OCH3(g)��H2O(g)
![]() 1.64 0 0
1.64 0 0
![]() 2x x x
2x x x
![]() 1.64��2x x x
1.64��2x x x
K��![]() ��400�����x��0.8����ƽ��ʱc(CH3OH)��1.64 mol��L��1��0.8 mol��L��1��2��0.04 mol��L��1��v(CH3OH)��
��400�����x��0.8����ƽ��ʱc(CH3OH)��1.64 mol��L��1��0.8 mol��L��1��2��0.04 mol��L��1��v(CH3OH)��![]() ��0.16 mol��L��1��min��1����(CH3OH)��
��0.16 mol��L��1��min��1����(CH3OH)��![]() ��100%��97.6%��
��100%��97.6%��
(3)��ͼ��֪���¶����ߣ�CO��ת���ʽ��ͣ�ƽ�����淴Ӧ�����ƶ������淴Ӧ�����ȷ�Ӧ������Ӧ�Ƿ��ȷ�Ӧ����H<0��ѹǿ�������ڼӿ췴Ӧ���ʣ�������ʹƽ�������ƶ�����ѹǿ������Ҫ�Ķ������豸��Ҫ��Ҳ�ߣ���250����1.3��104kPaʱ��CO��ת�����ѽϸߣ�������ѹǿ��CO��ת���ʱ仯����û�б�Ҫ������ѹǿ��

 ��У��ҵ��ϵ�д�
��У��ҵ��ϵ�д� ���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
���ɶ���ܲ��¿�ֱͨ��Уϵ�д�