题目内容
16.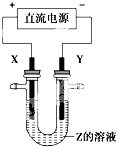 铝及铝合金经过阳极氧化,铝表面能生成几十微米的氧化铝膜.某研究性学习小组模拟工业法对铝片表面进行氧化处理,其装置如下图所示.现以铅为阴极,铝片为阳极,以硫酸溶液为电解液,按照如图连接电解装置,电解40min后取出铝片,用水冲洗,在其表面即可得到致密的氧化膜.下列有关说法正确的是( )
铝及铝合金经过阳极氧化,铝表面能生成几十微米的氧化铝膜.某研究性学习小组模拟工业法对铝片表面进行氧化处理,其装置如下图所示.现以铅为阴极,铝片为阳极,以硫酸溶液为电解液,按照如图连接电解装置,电解40min后取出铝片,用水冲洗,在其表面即可得到致密的氧化膜.下列有关说法正确的是( )| A. | 电解时电流从电源正极→导线→铝极→铅极→导线→电源负极 | |
| B. | 在电解过程中,H+向阳极移动,SO42-向阴极移动 | |
| C. | 电解过程中阳极周围的pH明显增大 | |
| D. | 电解的总方程式可表示为2Al+6H+$\frac{\underline{\;通电\;}}{\;}$2Al3++3H2↑ |
分析 A、电解时电流从电源正极→负极,电流流向和电子流向相反,电流只经过导线;
B、在电解过程中,阳离子向阴极移动,阴离子向阳极移动;
C、电解时,阳极是活泼电极时,放电的是电极本身;
D、根据电解池的两极反应来分析电解的总反应.
解答 解:A、电流流向和电子流向相反,电解时电流从电源正极→导线→铝极,铅极→导线→电源负极,故A正确;
B、在电解过程中,硫酸中的氢离子向阴极移动,硫酸根离子向阳极移动,故B错误;
C、电解时,阳极是活泼金属铝电极时,放电的是电极本身,故C错误;
D、阳极是活泼金属铝电极,金属铝在该极失电子,阴极是氢离子得电子,所以电解的总方程式可表示为:2Al+6H+$\frac{\underline{\;通电\;}}{\;}$2Al3++3H2↑,故D正确.
故选AD.
点评 本题是对电解原理的考查,可以根据所学知识进行回答,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列元素中,族序数等于元素在周期表中的周期数的整数倍的是( )
| A. | O | B. | F | C. | P | D. | Cl |
7.下列离子方程式中正确的是( )
| A. | 将少量SO2气体通入氨水中:SO2+NH3•H2O═NH4++HSO3- | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| C. | 向NaOH溶液中滴入少量AlCl3溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | 向稀硫酸加入少量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
4.下列关于物质用途的叙述中正确的是( )
| A. | Na2O可用作呼吸面具中的供氧剂 | |
| B. | 在常温下可用铝制容器贮藏运输浓硫酸 | |
| C. | 纯碱可作治疗胃酸过多的一种药剂 | |
| D. | SO2可用于漂白一切有色物质 |
8.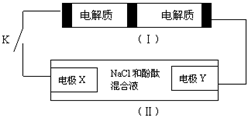 下图装置Ⅰ是一种可充电电池,装置Ⅱ为电解池.装置Ⅰ的离子交换膜只允许Na+通过,已知电池充放电的化学方程式为:
下图装置Ⅰ是一种可充电电池,装置Ⅱ为电解池.装置Ⅰ的离子交换膜只允许Na+通过,已知电池充放电的化学方程式为:
2Na2S2+NaBr3化气 $?_{充电}^{放电}$ Na2S4+3NaBr
当闭合开关K时,X电极附近溶液变红.下列说法正确的是( )
 下图装置Ⅰ是一种可充电电池,装置Ⅱ为电解池.装置Ⅰ的离子交换膜只允许Na+通过,已知电池充放电的化学方程式为:
下图装置Ⅰ是一种可充电电池,装置Ⅱ为电解池.装置Ⅰ的离子交换膜只允许Na+通过,已知电池充放电的化学方程式为:2Na2S2+NaBr3化气 $?_{充电}^{放电}$ Na2S4+3NaBr
当闭合开关K时,X电极附近溶液变红.下列说法正确的是( )
| A. | 闭合开关K时,钠离子从右到左通过离子交换膜 | |
| B. | 闭合开关K时,负极反应式为:3NaBr-2e-═NaBr3+2Na+ | |
| C. | 闭合开关K时,X电极反应式为:2Cl--2e-═Cl2↑ | |
| D. | 闭合开关K时,当有0.1molNa+通过离子交换膜,X电极上析出标准状况下气体1.12L |