题目内容
(1)少量Cl2通入FeI2(aq)中,反应的离子方程式是 ;
(2)过量Cl2通入FeI2(aq)中,反应的离子方程式是 ;
(3)将1.2 mol Cl2通入含有FeI2 1.0 mol的水溶液中: 。
(1)2I-+Cl2====2Cl-+I2
(2)2Fe2++4I-+3Cl2====6Cl-+2Fe3++2I2
(3)2Fe2++10I-+6Cl2====2Fe3++5I2+12Cl-
(2)2Fe2++4I-+3Cl2====6Cl-+2Fe3++2I2
(3)2Fe2++10I-+6Cl2====2Fe3++5I2+12Cl-
还原性强的,首先要失电子,故(1)中只有I-失电子;而(2)中I-和Fe2+都失电子,二者全部被氧化;(3)中I-全部被氧化,Fe2+部分被氧化:
n(氧化I-的Cl2)=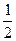 n(I-)="1.0" mol
n(I-)="1.0" mol
n(氧化Fe2+的Cl2)=n总(Cl2)-n(氧化I-的Cl2)="0.2" mol
n(被氧化的Fe2+)="0.4" mol
n反(I-)∶n反(Fe3+)∶n反(Cl2)="2.0" mol∶0.4 mol∶1.2 mol=5∶1∶3。
据此,可写出离子方程式。
n(氧化I-的Cl2)=
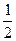 n(I-)="1.0" mol
n(I-)="1.0" moln(氧化Fe2+的Cl2)=n总(Cl2)-n(氧化I-的Cl2)="0.2" mol
n(被氧化的Fe2+)="0.4" mol
n反(I-)∶n反(Fe3+)∶n反(Cl2)="2.0" mol∶0.4 mol∶1.2 mol=5∶1∶3。
据此,可写出离子方程式。

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
 +2H
+2H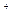
 H
H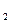 O。正确的离子方程式是___________。
O。正确的离子方程式是___________。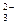 +2H
+2H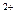 +Al
+Al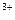 。正确的离子方程式是________。
。正确的离子方程式是________。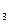 ↓。正确的离子方程式是__________________________________________________________________。
↓。正确的离子方程式是__________________________________________________________________。
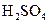 与
与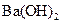 溶液反应:
溶液反应: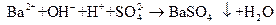

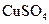 溶液吸收
溶液吸收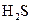 气体:
气体: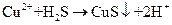
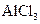 溶液中加入过量的浓氨水:
溶液中加入过量的浓氨水:
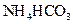 稀溶液混合:
稀溶液混合: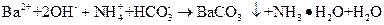
 4Ag+ O2↑+ 2H2O
4Ag+ O2↑+ 2H2O Al(OH)3↓+OH-
Al(OH)3↓+OH- H2↑+ Cl2↑
H2↑+ Cl2↑ 2Ag++H2↑
2Ag++H2↑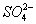 +Ba2+
+Ba2+