题目内容
用水热法制备Fe3O4纳米颗粒的总反应如下:3Fe2++ 2S2O32-+O2+4OH-= Fe3O4 + S4O62-+2H2O。下列说法正确的是
- A.在反应中1molO2氧化了3mol Fe2+
- B.还原剂是Fe2+,氧化剂是S2O32-和O2
- C.每生成1mol Fe3O4,转移3mol电子
- D.当转移1mol电子时,消耗56gS2O32-
D
考查氧化还原反应相关知识点
反应中两个亚铁离子的化合价由+2价升至+3价(Fe3O4中有两个+3价铁), S2O32-中的四个硫全部转变为S4O62-,总体化合价由+8价升至+10价,升高2价,共升高四价;而氧气中氧元素由0价降至—2价,降低四价,反应中有四个电子的转移
所以还原剂为Fe2+、2S2O32-,氧化剂为O2
A:1molO2氧化了2mol Fe2+
B:还原剂为Fe2+、2S2O32-,氧化剂为O2
C:每生成1mol Fe3O4,共转移4mol电子
D:由反应可看出,当有4mol电子转移时,消耗2molS2O32-,即224g,正确
答案为D
考查氧化还原反应相关知识点
反应中两个亚铁离子的化合价由+2价升至+3价(Fe3O4中有两个+3价铁), S2O32-中的四个硫全部转变为S4O62-,总体化合价由+8价升至+10价,升高2价,共升高四价;而氧气中氧元素由0价降至—2价,降低四价,反应中有四个电子的转移
所以还原剂为Fe2+、2S2O32-,氧化剂为O2
A:1molO2氧化了2mol Fe2+
B:还原剂为Fe2+、2S2O32-,氧化剂为O2
C:每生成1mol Fe3O4,共转移4mol电子
D:由反应可看出,当有4mol电子转移时,消耗2molS2O32-,即224g,正确
答案为D

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
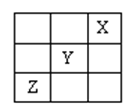
已知A、B、C、D、E分别为Ca(OH)2、Ca(HCO3)2、HCl、Ba(NO3)2、Na2CO3五种溶液中的一种。现将它们相互反应情况列表如下(表中“↓”表示生成沉淀;“↑”表示生成气体;“—”表示无现象)据此可判断C是
| A | B | C | D | E | |
| C | ↓ | ↓ | — | ↑ | — |
| B | ↓ | — | ↓ | — | — |
- A.HCl
- B.Ca(HCO3)2
- C.Na2CO3
- D.Ba(NO3)2
 w ww.k s5u. co m
w ww.k s5u. co m