题目内容
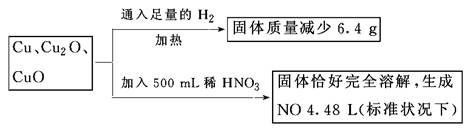
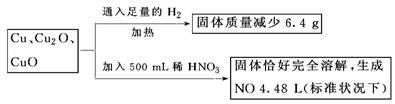
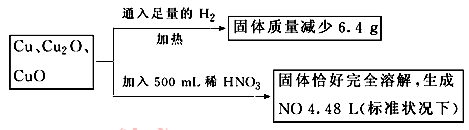
取一定质量含Cu、Cu2O、和CuO的固体混合物,将其分成两等份并进行下列转化:
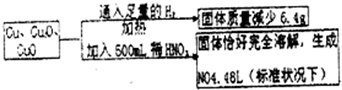
则转化过程中所加稀HNO3的物质的量浓度为
- A.3.2mol/L
- B.3.6mol/L
- C.4.0mol/L
- D.4.4mol/L
A
分析:考查铜及化合物的性质,并且利用有关化学方程式计算技能或原子守恒思想解决问题.
解答:设其中一份中n(Cu)=x mol,n(Cu2O)=y mol,n(CuO)=z mol,
依得失电子守恒和氧元素守恒,
有: ?x+2y+z=0.7mol
?x+2y+z=0.7mol
亦即反应后生成的硝酸铜的物质的量为0.70mol
则500mL稀硝酸中,n(HNO3)=0.70mol×2+0.200mol=1.600mol)
于是:c(HNO3)=1.600mol/0.500L=3.2mol/L,
故选:A.
点评:此题考查计算方法的技巧,电子守恒和原子守恒的思想,此思想是解决化学计算的简洁方法,应用比较广泛,应给予重视.
分析:考查铜及化合物的性质,并且利用有关化学方程式计算技能或原子守恒思想解决问题.
解答:设其中一份中n(Cu)=x mol,n(Cu2O)=y mol,n(CuO)=z mol,
依得失电子守恒和氧元素守恒,
有:
 ?x+2y+z=0.7mol
?x+2y+z=0.7mol亦即反应后生成的硝酸铜的物质的量为0.70mol
则500mL稀硝酸中,n(HNO3)=0.70mol×2+0.200mol=1.600mol)
于是:c(HNO3)=1.600mol/0.500L=3.2mol/L,
故选:A.
点评:此题考查计算方法的技巧,电子守恒和原子守恒的思想,此思想是解决化学计算的简洁方法,应用比较广泛,应给予重视.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目