题目内容
稀的醋酸溶液中存在平衡CH3COOH?CH3COO-+H+(正方向吸热),要使溶液中c(H+)减小,下列操作正确的是( )
分析:根据题意知,要使溶液中c(H+)减小,则加入的物质要和H+反应或降低温度抑制醋酸电离,据此分析解答.
解答:A.向溶液中加入氢氧化钠固体,氢氧化钠和氢离子反应生成水,所以能减少c(H+),故A正确;
B.向溶液中通入氯化氢气体,盐酸中含有氢离子,虽然能抑制醋酸电离,但溶液中增多的氢离子远远大于抑制醋酸电离的氢离子,所以溶液中c(H+)增大,故B错误;
C.升高温度,促进醋酸的电离,溶液中氢离子浓度增大,故C错误;
D.加入纯醋酸,平衡向正反应方向移动,导致溶液中氢离子浓度增大,故D错误.
故选A.
B.向溶液中通入氯化氢气体,盐酸中含有氢离子,虽然能抑制醋酸电离,但溶液中增多的氢离子远远大于抑制醋酸电离的氢离子,所以溶液中c(H+)增大,故B错误;
C.升高温度,促进醋酸的电离,溶液中氢离子浓度增大,故C错误;
D.加入纯醋酸,平衡向正反应方向移动,导致溶液中氢离子浓度增大,故D错误.
故选A.
点评:本题考查了影响弱电解质电离的因素,难度不大,注意:如果加入含有相同离子的物质就抑制其电离,如果加入和弱电解质电离的离子发生反应的物质就促进其电离.

练习册系列答案
相关题目
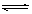 CH3COO-+H+,加少量烧碱溶液可使溶液中
CH3COO-+H+,加少量烧碱溶液可使溶液中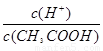 值增大。
值增大。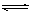 H++OH-逆向移动,c(H+)降低
H++OH-逆向移动,c(H+)降低